
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЛАБОРАТОРHАЯ РАБОТА №6.Дисперсные системы. Эмульсии
Цель работы: изучить способы получения и свойства эмульсий и пен, научиться получать эмульсии разных типов и определять их тип.
Оборудование и реактивы: спиртовой раствор серы, спиртовой раствор канифоли, золь гидроксида железа, КNO3, K2SO4, К3[Fe(CN)6], масло, ПАВ, ВaCl2Na2SO4.
Теоретическая часть:Эмульсиями называются дисперсные системы, в которых дисперсионная среда и дисперсная фаза находятся в жидком состоянии. На практике чаще всего встречаются водные эмульсии, т.е. эмульсии в которых одной из двух жидкостей является вода. Такие эмульсии подразделяются на два типа: масло в воде (сокращенно - м/в) и вода в масле (м/в). Малополярные органические жидкости - бензол, бензин, керосин, анилин, масло и др.,- независимо от их химической природы, называют маслом.
В эмульсиях первого типа (прямых) масло является дисперсионной фазой, а вода - дисперсионной средой. В эмульсиях второго типа (обратных) вода является раздробленной в виде капелек дисперсной фазой, а масло - дисперсионной средой.
В зависимости от содержания дисперсной фазы эмульсии классифицируют на разбавленные [содержание дисперсной фазы (φ менее 1 % (об.)], концентрированные [φ до 74 % (об.)] и высококонцентрированные [φ свыше 74 % (об.)].
Потеря агрегативной устойчивости эмульсий обусловлена процессами изотермической перегонки или коалесценции и обычно сопровождается потерей седиментационной устойчивости (расслоением системы). В качестве меры устойчивости эмульсии можно принять время существования ее определенного объема до полного расслоения.
Устойчивость эмульсии повышают введением в систему стабилизатора (эмульгатора), в качестве которого можно использовать электролиты, ПАВ и высокомолекулярные соединения. Агрегативная устойчивость эмульсий определяется теми же факторами, которые обусловливают устойчивость к коагуляции золей.
Разбавленные эмульсии достаточно устойчивы в присутствии электролитов, так как устойчивость связана с наличием двойного электрического слоя. Устойчивость концентрированных и высококонцентрированных эмульсий определяется действием структурно-механического барьера при образовании адсорбционных слоев эмульгатора. Наиболее сильное стабилизирующее действие оказывают ВМС и коллоидные ПАВ (мыла, неионогенные ПАВ), адсорбционные слои которых имеют гелеобразную структуру и сильно гидратированы.
Тип эмульсии, образующейся при механическом диспергировании, в значительной мере зависит от соотношения объемов фаз. Жидкость, содержащаяся в большем объеме, обычно становится дисперсионной средой. При равном объемном содержании двух жидкостей при диспергировании возникают эмульсии обоих типов, но «выживает» из них та, которая имеет более высокую агрегативную устойчивость и определяется природой эмульгатора. Способность эмульгатора обеспечивать устойчивость эмульсии того или иного типа определяется энергетикой взаимодействия его с полярной и неполярной средами, которая может быть охарактеризована при помощи полуэмпирической характеристики - числа гидрофильно-липофильного баланса (ГЛБ) поверхностно-активных веществ. ПАВ, имеющие низкие значения ГЛБ (2...6), лучше растворимы в органических средах и стабилизируют эмульсии в/м, тогда как при ГЛБ = 12.. .18 ПАВ лучше растворяются в воде и стабилизируют эмульсии м/в.
Щелочные соли жирных кислот средней молекулярной массы всегда дают эмульсии типа м/в, а соли двухвалентных металлов, например магния, - эмульсии в/м. При постепенном увеличении концентрации двухвалентных ионов в эмульсии м/в, стабилизированной мылом с катионом однозарядного металла, происходит обращение эмульсии и ее переход в эмульсию типа в/м.
Особый случай представляет стабилизация эмульсий высокодисперсными порошками. Такая стабилизация возможна при ограниченном избирательном смачивании порошков (при краевом угле 0° < 9 < 180°). При этом порошки лучше стабилизируют ту фазу, которая хуже смачивается. Краевой угол, характеризующий избирательное смачивание, при объяснении стабилизации эмульсий тонкодисперсными порошками является аналогом ГЛБ молекул ПАВ.
На практике тип эмульсий определяют следующими методами. По методу разбавления каплю эмульсии вносят в пробирку с водой. Если капля равномерно распределяется в воде, - это эмульсия м/в. Капля эмульсии в/м диспергироваться в воде не будет. Согласно методу окрашивания непрерывной фазы несколько кристаллов водорастворимого красителя, например, метилового оранжевого окрашивают эмульсию м/в равномерно по всему объему. Эмульсия в/м равномерно окрашивается по всему объему жирорастворимым красителем. Тип эмульсий можно определить по ее электропроводности. Высокие значения электропроводности указывают на то, что дисперсионной средой является полярная жидкость, а эмульсия относится к типу м/в. Малые значения электропроводности показывают на образование обратной эмульсии.
Эмульсии со временем разрушаются. В некоторых случаях возникает необходимость ускорить разрушение эмульсий, например, разрушение эмульсии в сырой нефти. Ускорить процесс разрушения можно всеми путями, ведущими к уменьшению прочности защитной пленки эмульгатора и увеличению возможности соприкосновения частиц друг с другом.
Методов разрушения эмульсии (деэмульгирования) очень много. Наиболее важными из них являются следующие:
1. Химическое разрушение защитных пленок эмульгатора, например, действием сильной минеральной кислоты.
2. Прибавление эмульгатора, способного вызвать обращение фаз эмульсии и снижающего этим прочность защитной пленки.
3. Термическое разрушение - расслоение эмульсий нагреванием. С повышением температуры уменьшается адсорбция эмульгатора, что ведет к разрушению эмульсии.
4. Механическое воздействие. К этому методу относится механическое разрушение стабилизированных пленок, например, сбивание сливок в масло. Центрифугирование также относится к механическому воздействию.
5. Действие электролитов вызывает разрушение эмульсий, стабилизированных электрическим зарядом частиц.
Экспериментальная часть:
Опыт 1. Получение дисперсных систем:
В пробирку налейте 1 мл дистиллированной воды, добавьте туда 2 капли спиртового раствора канифоли или серы. Что наблюдаете? Каким способом получена данная дисперсная система? Что является дисперсной фазой и дисперсионной средой? К какому типу относится полученная дисперсная система?
В пробирку налейте раствор ВаСl2 и добавьте 3 капли раствора сульфат натрия. Напишите уравнение происходящей реакции, изобразите схему полученной мицеллы. Какой заряд имеет дисперсная частица? Какие ионы образуют диффузный слой мицеллы? Оставьте пробирку на 5-10 мин. Что вы можете сказать о кинетической устойчивости полученного золя и предполагаемом размере частиц дисперсной фазы?
Опыт 2. Коагуляция золей электролитами.
В три пробирки налейте по 15 капель золя гидроксида железа, полученного в результате полного гидролиза хлорида железа (III). В первую пробирку добавьте 1 каплю нитрата калия, во вторую – сульфата калия, в третью – К3[Fe(CN)6] при интенсивном встряхивании. Каждую следующую каплю добавляйте через 1-2 мин, после предыдущей до тех пор, пока не будет наблюдаться помутнение содержимого в пробирке. Запишите результаты каждого опыта в таблицу.
Таблица 1. Коагуляция золей электролитами
| №пробирки | Электролит | Число капель, вызвавших помутнение | Порог коагуляции |
| КNO3 | |||
| K2SO4 | |||
| К3[Fe(CN)6] |
Рассчитайте порог коагуляции по формуле:
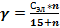 , где с- концентрация электролита, n-число капель электролита, вызвавших коагуляцию.
, где с- концентрация электролита, n-число капель электролита, вызвавших коагуляцию.
Ион какого знака вызывает коагуляцию? Сделайте вывод о знаке заряда частицы золя гидроксидажелеза, изобразите схему данной частицы.
Опыт 3. Стабилизация дисперсных систем адсорбционным методом.
Налейте в пробирку по 3 мл воды и 7 капель масла, а во вторую- 3 мл масла и 7 капель воды. После тщательного встряхивания определите тип эмульсии. Что является дисперсионной фазой и дисперсной средой в полученных эмульсиях? Что можно сказать о ее устойчивости? Добавьте в каждую пробирку 5 капель раствора ПАВ. Оставьте пробирки на 1-2 мин. Что происходит? Оцените устойчивость дисперсных систем в каждой пробирке. Изобразите схематически строение стабилизированных частиц дисперсной фазы.
Вопросы к защите
1. Что такое дисперсные системы, приведите примеры разных типов дисперсных систем.
2. Признаки дисперсных систем.
3. Понятие эмульсий, их классификация.
4. Охарактеризуйте методы получения дисперсных систем.
5. Что такое коагуляция? Порог коагуляции?
6. Как происходит коагуляция золей электролитами?
7. Устойчивость дисперсных систем.
8. Что такое ПАВ?
| <== предыдущая страница | | | следующая страница ==> |
| Лабораторная работа №5. ПРИГОТОВЛЕНИЕ РАСТВОРОВ | | | Лабораторная работа №7.Качественный анализ |
Дата добавления: 2014-11-15; просмотров: 426; Нарушение авторских прав

Мы поможем в написании ваших работ!