
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Аналитические реакции катионов V группы
7.1 Аналитические реакции катионов меди Cu2+
Аквакомплексы катионов меди (II) [Cu(H2O)n]2+ окрашены в голубой цвет, поэтому растворы солей меди (II) имеют голубую окраску с различными оттенками: от голубого до сине-зеленого. В водных растворах катионы меди (II) частично гидролизуются, поэтому аквакомплексы могут иметь состав: [Cu(H2O)n−m(OH)m]2−m. Реакция гидролиза:
[Cu(H2O)n]2+ + m H2O ↔ [Cu(H2O)n−m(OH)m]2−m + m H3O+. (7.1)
1.Взаимодействоие со щелочами. При реакции солей меди (II) со щелочами выпадает осадок гидроксида меди (II) Сu(OH)2, имеющий окраску от сине-зеленой до голубой:
Cu2+ + 2 OH− → Cu(OH)2↓. (7.2)
голубой ос.
При кипячении раствора с осадком Cu(OH)2 выпадает черный осадок оксида меди (II):
tº
Cu(OH)2↓ —→ CuO↓ + H2O. (7.3)
черный ос.
Осадок Cu(OH)2 растворяется в кислотах и в водном растворе аммиака NH4OH.
2.При добавлении раствора аммиака к раствору соли меди (II) вначале выпадает осадок основной соли меди (сине-зеленого цвета), который растворяется в избытке аммиака с образованием комплексного катиона [Cu(NH3)4]2+ синего (василькового) цвета:
CuCl2 + NH4OH → [Cu(NH3)4]2+ + OH− + Cl− + 4 H2O. (7.4)
р-р василькового цв.
В кислой среде комплекс разрушается:
[Cu(NH3)4]2+ + 4 H3O+ → [Cu(H2O)4]2+ + 4 NH4+,
и окраска из ярко-синей переходит в голубую. Данной реакции мешают катионы Co2+, Ni2+.
3.Катионы Cu2+ образуют с гексацианоферратом (II) калия K4[Fe(CN)6] в слабо-кислой среде красно-коричневый осадок:
2 Cu2+ + [Fe(CN)6]4− → Сu2[Fe(CN)6]↓. (7.5)
красно-коричнев. ос.
Осадок не растворяется в кислотах, но растворяется в аммиаке:
Сu2[Fe(CN)6]↓ + 12 NH3 + 4 H2O → (NH4)4[Fe(CN)6] +
+ 2 [Cu(NH3)4] (OH)2. (7.6)
Мешают данной реакции катионы Fe3+, Co2+, Ni2+.
4.При кипячении смеси подкисленного раствора соли меди (II) с избытком тиосульфата натрия Na2S2O3 происходит реакция восстановления меди (II) до меди (I) с образованием сульфида Cu2S. В результате выпадает темно-бурый осадок, состоящий из смеси: Cu2S + S:
2 Cu2+ + 2 S2O32− + 2 H2O → Cu2S↓ + S↓ + 4 H+ + 2 SO42−. (7.7)
темно-бурый ос.
5.Сероводород и сульфиды образуют с солями меди (II) осадок сульфида меди черного цвета, растворимый в азотной кислоте:
Cu2+ + S2− → CuS↓. (7.8)
черный ос.
6.Другие реакции катиона меди (II). При взаимодействии солей меди с тиоцианатами образуется черный осадок тиоцианата меди (II) Cu(SCN)2, постепенно переходящий в белый осадок тиоцианата меди (I) CuSCN; при взаимодействии солей меди с фосфатами образуется голубой осадок фосфата меди (II) Cu3(PO4)2.
7.2 Аналитические реакции катионов кадмия Cd2+
Аквакомплексы катионов кадмия Cd2+ в водных растворах имеют состав [Cd(H2O)4]2+, они бесцветны.
1.При добавлении раствора щелочи или аммиака к раствору соли кадмия (II) выпадает белый осадок гидроксида:
Cd2+ + 2 OH− → Cd(OH)2↓. (7.9)
белый ос.
Осадок нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного комплекса [Cd(NH3)4]2+:
Cd(OH)2↓ + 4 NH3 → [Cd(NH3)4]2+ + 2 OH−. (7.10)
Осадок гидроксида кадмия растворим также в кислотах:
Cd(OH)2↓ + 2 H3O+ → [Cd(H2O)4]2+. (7.11)
2.Катионы кадмия Cd2+ образуют с анионами сульфида S2− в слабокислой или щелочной среде желтый осадок сульфида кадмия CdS:
Cd2+ + S2− → CdS↓. (7.12)
желтый ос.
Осадок не растворяется в щелочах и избытке раствора сульфида натрия; частично растворяется в насыщенном растворе хлорида натрия с образованием комплекса [CdCl4]2−:
CdS↓ + 4 Cl− → [CdCl4]2− + S2−. (7.13)
Сульфид кадмия нерастворим в кислотах, за исключением соляной:
CdS↓ + 4 HCl → H2[CdCl4] + H2S. (7.14)
3.Другие реакции катиона кадмия. Тиосульфат натрия Na2S2O3 не взаимодействует с солями кадмия (II). Сульфид кадмия в данном случае не образуется.
7.3 Аналитические реакции катионов ртути Hg2+
Аквакомплексы катионов ртути (II) в водных растворах имеют строение [Hg(H2O)n]2+, и они бесцветны.
1.При добавлении водного раствора щелочи к растворам солей ртути (II) выпадает желтый осадок оксида ртути (II):
Hg2+ + 2 OH− → Hg(OH)2↓; Hg(OH)2↓ → HgO↓ + H2O. (7.15)
желтый ос.
Осадок HgO растворяется в азотной кислоте, в растворах хлоридов и иодидов щелочных металлов с образованием соответствующих соединений:
HgO↓ + 2 HNO3 → Hg(NO3)2 + H2O;
HgO↓ + 2 Сl− + H2O → HgCl2 + 2 OH−;
HgO↓ + 4 I− + H2O → [HgI4]2− + 2 OH−.
2.При взаимодействии с водным раствором аммиака катионы Hg2+ образуют белые осадки:
HgCl2 + 2 NH3 → HgNH2Cl2↓ + NH4Cl; (7.16)
белый осадок
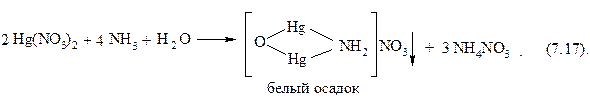
Осадки растворяются (лучше при нагревании) в избытке аммиака с образованием бесцветного комплексного катиона [Hg(NH3)4]2+:
HgNH2Cl2↓ + 2 NH3 + NH4+ → [Hg(NH3)4]2+ + Cl−; (7.18)
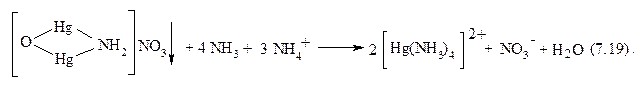 3.Катионы Hg2+ при взаимодействии с ионами иодида в водном растворе образуют красный осадок иодида ртути (II), который растворяется в избытке реактива:
3.Катионы Hg2+ при взаимодействии с ионами иодида в водном растворе образуют красный осадок иодида ртути (II), который растворяется в избытке реактива:
Hg2+ + 2 I− → HgI2↓; (7.20)
красный ос.
HgI2↓ + 2 I− → [HgI4]2−. (7.21)
Данной реакции мешают катионы Pb2+, Cu2+, Ag+.
4.Катионы Hg2+ осаждаются из водных растворов с помощью анионов сульфида S2− в виде черно-коричневого осадка HgS. Реакция протекает в несколько стадий. Вначале образуется белый осадок, постепенно меняющий окраску из желто-красной и бурой на коричнево-черную при избытке аниона S2−:
3 HgCl2 + 2 H2S → (HgS)2 ∙ HgCl2↓ + 4 HCl; (7.22)
белый ос.
(HgS)2 ∙ HgCl2 + H2S → 3 HgS↓ + 2 HCl. (7.23)
черный ос.
Сульфид ртути HgS не растворяется в разбавленной азотной кислоте.
5.Тиосульфат натрия Na2S2O3 образует с солями ртути (II) осадки:
2 Hg2+ + 2 S2O32− + H2O → HgS↓ + Hg↓ + S4O62− + SO42− + 2 H+. (7.24)
черн.ос. черн.ос.
6.Другие реакции катионов ртути (II). С анионами хромата катионы ртути Hg2+ образуют желтый осадок HgCrO4; с анионами фосфата – белый осадок Hg3(PO4)2.
7.4 Аналитические реакции катионов кобальта Co2+
Аквакомплексы катионов кобальта (II) окрашены в водном растворе в розовый цвет. Они имеют строение [Co(H2O)6]2+.
1.Катионы кобальта при взаимодействии со щелочами образуют синий осадок основной соли кобальта (II) CoOHCl, который затем переходит в осадок гидроксида кобальта Сo(OH)2 розового цвета:
CoCl2 + OH− → CoOHCl↓ + Cl−; (7.25)
синий ос.
CoOHCl + OH− → Co(OH)2↓ + Cl−. (7.26)
розовый ос.
Розовый осадок гидроксида кобальта (II) постепенно приобретает черно-бурую окраску вследствие окисления его кислородом воздуха до гидроксида кобальта (III):
4 Co(OH)2↓ + O2 + 2 H2O → 4 Co(OH)3↓. (7.27)
черно-бурый ос.
2.При взаимодействии солей кобальта (II) с нитритом калия в уксусно-кислой среде образуется желтый кристаллический осадок гексанитрокобальтата (III) калия:
а) Co2+ + NO2− + 2 CH3COOH → NO↑ + 2 CH3COO− + Co3+ + H2O;
б) Co3+ + 6 NO2− → [Co(NO2)6]3−;
в) [Co(NO2)6]3− + 3 K+ → K3[Co(NO2)6]↓. (7.28)
желтый ос.
3.При взаимодействии солей кобальта (II) с раствором аммиака вначале образуется синий осадок основной соли. Добавление избытка раствора аммиака приводит к растворению осадка и образованию аммиаката кобальта [Co(NH3)6]2+ желтого цвета:
а) CoCl2 + NH4OH → CoOHCl↓ + NH4Cl;
синий ос.
б) CoOHCl↓ + 5 NH3 + NH4Cl → [Co(NH3)6]Cl2 + H2O. (7.29)
желтый р-р.
При длительном стоянии на воздухе раствор постепенно приобретает вишнево-красный цвет вследствие окисления кобальта (II) до кобальта (III):
4 [Co(NH3)6]Cl2 + 2 H2O +O2 → 4 [Co(NH3)5Cl](OH)2 + 4 NH3. (7.30)
вишнево-красн.р-р
В присутствие пероксида водорода и хлорида аммония реакция окисления протекает практически мгновенно:
2 [Co(NH3)6]Cl2+Н2O2+NH4Cl→2 [Co(NH3)5Cl]Cl2+ 4 NH3+2 H2O. (7.31)
вишнево-красн.р-р
4.Катионы кобальта в слабокислой среде реагируют с анионами тиоцианата с образованием комплекса синего цвета:
Co2+ + 4 NCS− ↔ [Co(NCS)4]2−. (7.32)
синий р-р
Комплекс в водных растворах неустойчив, поэтому реакцию проводят с использованием растворов солей кобальта (II) и кристаллической соли KNCS (NH4NCS). Реакции мешают катионы Fe3+ и Cu2+.
5.Катионы кобальта (II) при взаимодействии с анионами сульфида S2− образуют черный осадок сульфида кобальта:
Co2+ + S2− → CoS↓. (7.33)
черный ос.
Осадок растворим в азотной кислоте.
6.Тиосульфат натрия Na2S2O3 не взаимодействует с солями кобальта (II).
7.5 Аналитические реакции катионов никеля Ni2+
Аквакомплексы катиона никеля (II) в водных растворах имеют состав [Ni(H2O)6]2+ и окрашены в зеленый цвет.
1.Катионы Ni2+ осаждаются щелочами из водных растворов в виде гидроксида Ni(OH)2 зеленого цвета:
Ni2+ + 2 OH− → Ni(OH)2↓. (7.34)
зеленый ос.
Осадок растворяется в кислотах и аммиаке:
Ni(OH)2↓ + 2 H+ → Ni2+ + 2 H2O; (7.35)
Ni(OH)2↓ + 6 NH3 → [Ni(NH3)6]2+ + 2 OH−. (7.36)
синий р-р
2.При взаимодействии солей никеля (II) с аммиаком выпадают светло-зеленые осадки основных солей никеля (II):
Ni(NO3)2 + NH4OH → NiOHNO3↓ + NH4NO3; (7.37)
светло-зел. ос.
NiSO4 + 2 NH4OH → (NiOH)2SO4↓ + (NH4)2SO4.
светло-зел. ос.
В избытке раствора аммиака основные соли никеля растворяются с образованием комплексов синего цвета:
NiOHCl↓ + 6 NH3 → [Ni(NH3)6]2+ + OH− + Cl−. (7.38)
светло-зел. ос. синий р-р.
3.Реакция с раствором диметилглиоксима (реакция Чугаева). Катионы никеля Ni2+ при взаимодействии с диметилглиоксимом при рН 6-9 образуют растворимые в воде внутрикомплексные соединения розово-красного цвета:
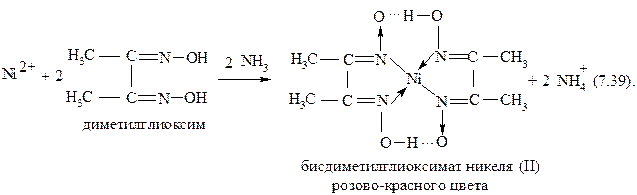
Реакцию проводят в среде аммиака. Осадок растворяется в сильных кислотах и щелочах, не растворяется в избытке аммиака. Катионы кобальта Co2+ не мешают реакции определения никеля (II); мешают реакции катионы: Cu2+, Pb2+, Fe2+, Fe3+.
Реакцию можно провести капельным методом на фильтровальной бумаге. Для этого на лист фильтровальной бумаги наносят каплю раствора соли никеля (II), затем - каплю спиртового раствора диметилглиоксима. Бумагу держат над склянкой с концентрированным раствором аммиака (в парах аммиака) до появления розово-красного пятна.
4.Сероводород и сульфиды при действии на растворы солей никеля (II) приводят к образованию черного осадка сульфида никеля NiS:
Ni2+ + S2− → NiS↓. (7.40)
черный ос.
5.Реакция с хлорной водой в щелочной среде:
а) Ni2+ + 2 OH− → Ni(OH)2↓.
зеленый ос.
б) 2 Ni(OH)2↓ + Cl2 + 2 NaOH → Ni(OH)3↓ + 2 NaCl. (7.41)
черный ос.
В таблице 7.1 представлены некоторые аналитические реакции катионов V группы и свойства продуктов реакций.
Таблица 7.1
Продукты некоторых аналитических реакций катионов V группы
| Реагенты | Продукты аналитических реакций катионов | ||||
| Cu2+ | Cd2+ | Hg2+ | Co2+ | Ni2+ | |
| NaOH, KOH | Голубовато-зеленый осадок CuOHCl. | Белый осадок Cd(OH)2. | Желтый осадок HgO. | Голубой осадок CoOHCl. | Зеленый осадок NiOHCl. |
| NH4OH (избыток) | Синий раствор [Cu(NH3)4]2+ | Бесцветн. раствор [Cd(NH3)4]2+ | Бесцветн. раствор [Hg(NH3)4]2+ | Желтый раствор [Co(NH3)6]2+ | Сине-фиолетов. раствор [Ni(NH3)6]2+ |
| Na2CO3 | Голубой осадок (СuOH)2CO3 | Белый осадок (CdOH)2CO3 | Красно-бурый осадок HgCO3 или (HgOH)2CO3 | Розово-фиолетов. осадок (CoOH)2CO3 | Зеленый осадок (NiOH)2CO3 |
| Na2HPO4 | Голубой осадок CuHPO4, Cu3(PO4)2 | Белый осадок CdHPO4, Cd3(PO4)2 | Белый осадок HgHPO4, Hg3(PO4)2 | Фиолетов. осадок CoHPO4, Co3(PO4)2 | Зеленый осадок NiHPO4, Ni3(PO4)2 |
| (NH4)2S, H2S, Na2S | Черный осадок CuS | Желтый осадок CdS | Черный осадок HgS | Черный осадок CoS | Черный осадок NiS. |
| K4[Fe(CN)6] | Красно-коричнев. осадок Cu2[Fe(CN)6] растворим в аммиаке. | - | - | - | - |
| Na2S2O3 + H2SO4 | Бурый осадок Cu2S + S. | - | Черный осадок HgS + Hg. | - | - |
| KNCS | - | - | - | Раствор синего цвета [Co(NCS)4]2- | - |
| <== предыдущая страница | | | следующая страница ==> |
| Анализ смеси катионов I аналитической группы | | | Анализ смеси катионов V аналитической группы |
Дата добавления: 2014-11-15; просмотров: 1122; Нарушение авторских прав

Мы поможем в написании ваших работ!