
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Как возникает насыщенный пар и происходит конденсация?
При охлаждении любого реального газа при постоянном давлении Р до определенной температуры наступает момент, когда вещество разделяется на две фазы: конденсированную и газообразную. Давление Р должно быть меньше некоторой величины, которая носит название критическое давление Ркрит для данного вещества. Рассмотрим механизм перехода от газообразного состояния к состоянию с двумя фазами: конденсированной и газообразной.
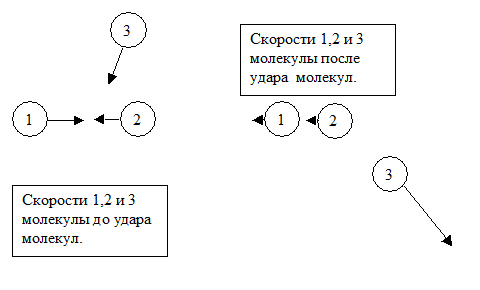
Когда две свободные молекулы, находившиеся далеко друг от друга, и имевшие средние кинетические энергии, соответствующие температуре газа, сближаются на расстояние R0, соответствующее минимуму потенциальной энергии их взаимодействия, суммарная кинетическая энергия этих двух молекул в этот момент вырастает. В этот же момент может произойти удар с третьей молекулой, которая заберет себе возникший избыток кинетической энергии. Относительная скорость первой и второй молекул может стать близкой к нулю. Две молекулы после такого удара с третьей попадают в «плен» друг к другу и в дальнейшем живут вместе «парой».
Совместная жизнь продолжается до тех пор, пока какой-нибудь из ударов с ещё одной молекулой не приведет к увеличению энергии возникшей пары до величины, когда молекулы смогут вновь разбежаться. Судьба пары может быть и иной – к ней может дополнительно присоединиться одна или несколько молекул. При термодинамическом равновесии вещества в газообразном состоянии в нем устанавливается определенная пропорция концентраций одиночных молекул, пар, троек и т.д.
Именно это распределение (устройство насыщенного пара) нас интересует. Рассмотрим ситуацию (самую простую), при которой система одноатомных молекул обменивается теплом с окружающей средой и имеет фиксированное внешнее давление. Это соответствует, например выделению небольшого объема внутри сплошной среды.
Какова будет устойчивость пребывания молекул в состоянии «газа» одиночных молекул при начальном условии равенства температуры газа температуре окружающей среды и при постоянном внешнем давлении?
Образование одной «пары» приводит к увеличению кинетической энергии молекул на величину, равную глубине потенциальной ямы U0. До попадания в плен друг к другу две одноатомные молекулы имели «на двоих» 6 степеней свободы, связанных с поступательным движением. «Пара» одноатомных молекул имеет три поступательных степени свободы, две вращательных и одну колебательную, которая вдвое более энергоемка, чем одна поступательная или одна вращательная степень свободы. В сумме получается, что две молекулы, объединившись, приобрели дополнительную теплоемкость kT/2. Допустим сначала, что объём и суммарная энергия системы из N молекул фиксированы и посмотрим, что будет с температурой системы и ее давлением после образования n пар.
Итак, выделилась энергия nU0, количество частиц уменьшилось на n, но теплоемкость СV увеличилась на величину nkT/2. Увеличение средней кинетической энергии поступательного движения молекул соответствует увеличению температуры пара. Увеличение температуры и изменение количества частиц приводят к изменению давления пара.
С учетом сделанных нами предположений о постоянстве объема и отсутствии теплообмена изменение локальных температуры и давления находятся в соответствии с формулами ([1]):
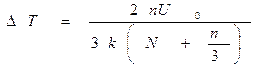 | 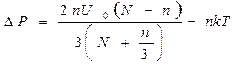 | ||
Эти формулы «подсказывают» нам, что при начальной температуре, меньшей, чем величина 2U0/3k, и температура и давление системы молекул после образования небольшого количества «пар» молекул увеличиваются. Следовательно, при наличии теплообмена с окружающей средой и фиксированном внешнем давлении система из N молекул начнет терять энергию, как за счет теплообмена, так и за счет совершения работы при расширении. Поскольку мы рассмотрели произвольное число N молекул, то наши заключения о поведении локальных температуры и давления относятся к любому физически малому объему вещества.
Вывод: в определенном диапазоне температур, меньших некоторой величины ([2]), состояние системы, когда все молекулы летают поодиночке, неустойчиво! Часть молекул со временем объединяются, и такое устройство вещества уже не называется газом, а называется паром. В конце концов, система должна прийти к некоторому динамически устойчивому (равновесному) распределению молекул по «одиночкам», «парам», «тройкам» и так далее вплоть до «очень большого» макроскопического объединения молекул – поверхности конденсированного вещества. Это равновесное состояние пара при данной температуре, когда одновременно существует и вещество в конденсированном состоянии и его пар, называется насыщенным паром. В справочники и таблицы физических величин помещают величины давления насыщенных паров разных веществ, существующих над плоской (не кривой) поверхностью раздела пара и конденсированного вещества.
Если при данной температуре концентрация пара меньше, чем концентрация насыщенного пара, то такой пар называется ненасыщенным (логично!).
Большое практическое значение имеет содержание водяных паров в воздухе. Чтобы его охарактеризовать, используют количественную характеристику – влажность воздуха. Влажность воздуха при данной температуре – это выраженная в процентах концентрация паров воды. За 100% при данной температуре принимают концентрацию молекул воды в насыщенном паре, который при данной температуре существует над плоской поверхностью раздела пара и конденсированного вещества.
Наличие притяжения удалённых друг от друга молекул позволяет объяснить несколько экспериментально наблюдаемых эффектов, связанных с давлением насыщенного пара над криволинейной поверхностью жидкости. Молекулы, находящиеся на «выпуклой» поверхности, имеют меньшее количество «дальних» соседей и, соответственно, находятся в менее глубокой потенциальной яме, чем такие же молекулы, находящиеся на плоской поверхности. На рисунке 8 одна из молекул, находящихся на выпуклой поверхности, отмечена оранжевым цветом.
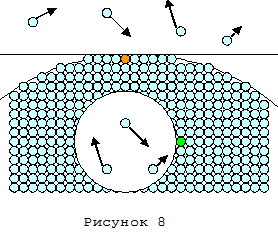
Добавок потенциальной энергии зависит от кривизны поверхности и тем больше, чем больше кривизна. ([3])
Дополнительное давление пропорционально кривизне поверхности (2/R). Обозначим коэффициент пропорциональности символом σп. Для капли в виде шарика радиуса R можно записать, что давление насыщенного пара над поверхностью шарика равно:
РВып. =РПлоск + 2σп/R.
Для пузырька радиуса R в жидкости давление насыщенного пара внутри пузырька равно:
РВогн. =РПлоск – 2σп/R.
Легко показать, что σп=σжρп/ρж, для этого достаточно рассмотреть равновесное положение жидкости и её насыщенного пара в закрытом сосуде. Жидкость находится на дне сосуда и в вертикальном капилляре. Стенки капилляра смачиваются жидкостью. Высоту подъема жидкости в капилляре находим из условия равновесия жидкости:
ρжgh = 2σж/R.
Давление насыщенного пара жидкости на этой высоте меньше, чем давление пара непосредственно над плоской поверхностью жидкости вблизи дна сосуда на малую величину ΔP = ρпgh. Отсюда:
ΔP = ρп2σж/(Rρж).
Оценки показывают, что повышение давления над кривой поверхностью становится очень существенным и сравнимым с давлением насыщенного пара над плоской поверхностью только при очень малых радиусах капель. Например, для воды при температуре 300 К эти величины сравниваются при радиусе кривизны капли 10 Ангстрем. Этот радиус соответствует примерно трем диаметрам молекулы воды.
Если пар тщательно очистить от пыли и не создавать в нем заряженных частиц, то при понижении температуры можно достичь такой плотности пара, которая будет значительно превышать плотность насыщенного пара над плоской поверхностью жидкости при данной температуре. Избыточное давление такого пересыщенного пара обеспечивается вторым членом в правой части уравнения (15). Если нет крупных капелек, то маленькие капельки не могут расти, даже в том случае, когда давление пара стало больше давления насыщенного пара (возле плоской поверхности жидкости) при данной температуре.
Пересыщенный пар получают в так называемых камерах Вильсона, предназначенных для регистрации энергичных частиц. Такая частица, пролетая сквозь пересыщенный пар, разбивает атомы и молекулы на осколки – ионы (заряженные частицы). Каждый образовавшийся ион притягивает к себе за счет индуцированного перераспределения зарядов нейтральные молекулы и является центром конденсации капельки жидкости. Затравочная капелька после достижения критического размера в дальнейшем растет сама по себе до тех пор, пока пар пересыщен. Цепочки капелек, образовавшихся в результате пролета энергичной частицы, «отмечают» траекторию её движения. Экспериментатор должен вовремя сфотографировать такую цепочку.
| <== предыдущая страница | | | следующая страница ==> |
| Модель Ван-дер-Ваальса | | | Поверхностные явления |
Дата добавления: 2014-11-20; просмотров: 355; Нарушение авторских прав

Мы поможем в написании ваших работ!