
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Модель Ван-дер-Ваальса
Модель Ван-дер-Ваальса (В-д-В) объясняет такие главные особенности поведения вещества как: Наличие так называемой критической температуры. Возможность существования вещества при «отрицательных» внешних давлениях (конденсированное состояние).
Уравнение Ван-дер-Ваальса получено из простых и ясных предположений:
Первое: молекулы имеют «собственный» объем. Из этого следует, что не весь объем, занятый веществом, доступен для «всех» молекул.
Второе: молекулы притягиваются друг к другу на больших расстояниях.
Это притяжение описывается дополнительным давлением, которое складывается с внешним давлением, оказываемым на вещество внешними телами. В качестве простого и очень удачного приближения для этого дополнительного давления была выбрана величина, обратно пропорциональная квадрату объема, занимаемого веществом.
Для одного моля молекул это уравнение выглядит так:
5. 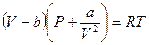 .
.
Зависимость объема фиксированной массы вещества от давления в модели В-д-В при любой постоянной температуре выше критической имеет однозначный характер, а при температурах ниже критической существуют участок давления газа, которому соответствуют три разных объема газа. Наличие двух сильно отличающихся друг от друга по наклону участков на графике зависимости давления газа от объема при фиксированной температуре ниже критической соответствует существованию двух фаз вещества: жидкости и пара.
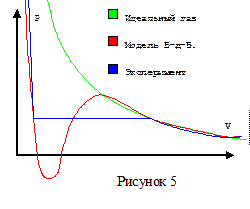
Кроме этих главных особенностей из модели В-д-В следует возможность существования таких неустойчивых состояний вещества как перегретая жидкость и пересыщенный пар. При данной температуре, которая ниже критической, фиксированному давлению вещества соответствуют три разных объема. Два из этих решений являются устойчивыми, а третье является неустойчивым, то есть модель В-д-В указывает на то, что вещество при определенных условиях должно расслоиться на две фазы с разными плотностями вещества в них.
Рисунок 5 показывает, что модель В-д-В лучше описывает экспериментальную зависимость, чем модель идеального газа. В уравнении В-д-В информация о взаимодействии молекул присутствует, хотя никаких конкретных характеристик молекул не используется. Параметры a и b подбираются для каждого вещества так, чтобы уравнение возможно лучше описывало поведение этого вещества. Традиционно в школьных учебниках для физ.–мат. школ вводят уравнение В-д-В, как модель, уточняющую уравнение идеального газа, и указывают на молекулярно-кинетическое обоснование этой модели. Её особенности обсуждают только при описании поведения газов.
| <== предыдущая страница | | | следующая страница ==> |
| Первое упрощение | | | Как возникает насыщенный пар и происходит конденсация? |
Дата добавления: 2014-11-20; просмотров: 202; Нарушение авторских прав

Мы поможем в написании ваших работ!