
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Модели, описывающие состояние реальных веществ
Для объяснения существования газообразных и конденсированных тел в школьной физике используется исправленное Ван–дер– Ваальсом (В-д-В) уравнение состояния газов, в котором феноменологически учитывается взаимодействие молекул на расстоянии. Уравнение В-д-В не описывает устройство вещества в твердом состоянии, так как в этом уравнении не заложены параметры, отличающие жидкость от твёрдого тела. Для обоснования сделанного исправления используется модельное представление о взаимодействии молекул. Считается, что потенциальная энергия взаимодействия двух молекул – шариков в модели зависит только от расстояния между их центрами и не зависит от наличия других молекул. Эти предположения, конечно, не соответствуют современным представлениям о взаимодействии молекул, но мы заранее договорились, что будем строить классическое объяснение, то есть рассматривать только классические модели.
Глубина потенциальной ямы U для каждой пары касающихся друг друга молекул самая большая. При низких температурах молекулы вещества в конденсированном состоянии располагаются так, что объем тела и суммарный «объем молекул» очень близки друг к другу. Молекулы занимают положения, соответствующие минимальной потенциальной энергии. Это приводит к размещению молекул в пространстве с наибольшей плотностью, когда каждая молекула имеет максимальное число соседей. Можно говорить, что молекулы касаются друг друга. При самой плотной упаковке, каждая молекула–шарик имеет 12 ближайших соседок, а при упаковке в кубической решетке каждая молекула–шарик имеет 6 ближайших соседок. Молекула живет в своеобразной ячейке – клетке, образованной её соседками. ([7])
При случайных хаотических движениях коллектива молекул отдельная молекула может приобрести достаточную энергию, чтобы преодолеть потенциальный барьер, созданный для неё соседками. При этом она может переместиться из своего положения равновесия в то место, где ее соседка отсутствует. Представление о том, что в конденсированном теле имеются вакансии в решетке (дефекты решетки), ввел физик Я.И. Френкель. Пустое или не занятое место в решетке = вакансия (точечный дефект решетки по Френкелю) может скачком переместиться на расстояние, равное диаметру молекулы. При наличии большого количества вакансий для каждой молекулы возникает возможность изредка сменить свое окружение, перебравшись из одной «ячейки» в другую.
Переход от твердой фазы к жидкой фазе соответствует появлению определенной доли узлов решетки, не занятых атомами. Если плотности вещества в соответствующих фазах вблизи точки перехода равны ρт и ρж, то характеристикой фазового перехода будет число:
N = ρт/(ρт-ρж).
Это среднее число узлов решетки, «оставшейся в наследство от твердого состояния», приходящихся на одну вакансию. Для водорода это число равно 8,7 ≈ 9. Для азота это число 4,7 ≈ 5. Для кислорода – 5. Для ртути 21,9 ≈ 22. Например, для ртути число 22 означает, что в среднем на каждые 21 атом ртути в жидком состоянии приходится одна вакансия.
Для большинства веществ теплота парообразования значительно больше теплоты плавления. Если исходить из представления о том, что переход к жидкости от твердого тела сопровождался появлением определенной доли вакансий в объеме, то это можно интерпретировать, как «испарение» части молекул из объема. Оставшаяся часть молекул испаряется в процессе перехода жидкость – пар. Таким образом, отношение теплоты парообразования (за вычетом работы против сил внешнего давления) к теплоте плавления должно быть близким к числу N «заполненных узлов», приходящихся на одну вакансию. Этот вывод можно подтвердить на примере нескольких веществ: ртути, азота, водорода, цинка, серебра, олова. Отношения плотности веществ в твердом состоянии к разности плотностей твердой и жидкой фазы равны:
Hg – 21,9 N2 – 4,7 Н2 – 8,7 Zn – 14,5 Ag – 20,0 Sn – 39.
Соответствующие отношения теплоты парообразования (минус работа против сил атмосферного давления) к теплоте плавления равны:
Hg – 23,5 N2 – 6,86 Н2 – 6,4 Zn – 14,6 Ag – 20,4 Sn – 38.
Как видно, отличие полученных значений не очень велико. Отличие даже в полтора – два раза это тоже не слишком большие отличия, а в такой диапазон попадает очень большое количество простых веществ.
Продолжая аналогию с испарением вещества при переходе «жидкость-пар», мы будем говорить, что при температуре фазового перехода «твердое тело – жидкость» достигается такое кинетическое давление молекул, что его уже не может удержать собственное давление вещества, связанное с притяжением удаленных молекул. Внешнее давление при обычных условиях играет малую роль в этом процессе, так как, например, атмосферное давление, при котором проводятся эксперименты, составляет весьма малую долю от собственного давления вещества. При этом происходит изотермический процесс расширения вещества (для большинства веществ), связанный с уменьшением собственного давления. [8] Условие равенства кинетического давления и собственного давления достигается для каждого вещества при вполне определенной температуре. Поэтому каждое вещество характеризуется своей уникальной температурой плавления.
Новое состояние (фаза) вещества и старая фаза вещества характеризуются при термическом равновесии средними глубинами потенциальных ям U1 и U2 для каждой молекулы. При наличии рядом с молекулой вакансии объем для свободного проживания центра масс молекулы больше, чем соответствующий объём для молекулы, окруженной соседками со всех сторон. Это соответствует меньшей концентрации в занятой движением центра масс области пространства. Указанные величины подчиняются определенному соотношению Больцмана:
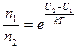
Здесь U1 и U2 это потенциальные энергии, которые имеет молекула в состоянии 1 и в состоянии 2. Величины концентраций n1 и n2 соответствуют средним объемам, в которых свободно движется центр масс молекулы.
Это соотношение определяет, как много при таком переходе (твердое тело – жидкость) возникнет вакансий. То есть сколько занятых узлов «остатков решетки» будут приходиться на одну возникшую вакансию. Их число зависит от вида взаимодействия конкретного сорта молекул. Чем больше возникает вакансий, тем менее глубокой становится потенциальная яма, и тем меньше становится концентрация. В силу разного характера зависимости правой и левой частей соотношения Больцмана от доли возникших вакансий (для уменьшения концентрации это примерно прямо пропорциональная зависимость от доли возникших вакансий, а для отношения концентраций это зависимость с экспонентой) для каждого вещества получается своё уникальное число N = ρт/(ρт-ρж).
Если молекулы имеют схожие свойства, то и числа N для них будут близкими. В таблице для иллюстрации этой идеи приведены данные только для благородных газов, которые при переходе в твердое состояние образуют одинаковые гранецентрированные кубические решетки.
| Вещество /параметр | Гелий | Неон | Аргон | Криптон | Ксенон |
| Температура Кельвин | 1,6 | ||||
| Теплота (Дж/моль) | |||||
| Плотн. тв. Кг\м3 | 190 (>25Атм) | ||||
| Плотн. ж. Кг\м3 | |||||
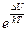
| 1.7 | 4.9 | 5.5 | 5.5 | 5.85 |
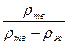
| 2.8 | 5,96 | 6,6 | 7,6 | 7,6 |
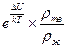
| 2.64 | 5,88 | 6.5 | 6,33 | 6,73 |
Как видно, для всех благородных газов (за исключением гелия, для которого важны квантовые эффекты, и радона, для которого нет данных в справочнике) вычисленные величины 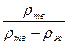 и
и 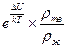 находятся в узком диапазоне 5,9 – 6,7.
находятся в узком диапазоне 5,9 – 6,7.
Наличие в объеме вещества вакансий нарушает строгую периодичность в распределении молекул по пространству. Если среднее расстояние между соседними вакансиями сравнимо с размерами тела, то можно считать, что все тело – это сплошное упорядоченное в пространстве объединение молекул. Такое тело принято называть кристаллом. Если же среднее расстояние между вакансиями значительно меньше, чем размеры тела, и сами вакансии занимают заметную часть объема тела, то говорить о строгой упорядоченности распределения молекул по пространству не приходится – это расположение молекул уже не назовешь кристаллом.
| <== предыдущая страница | | | следующая страница ==> |
| Переход конденсированное состояние – пар (и обратно) | | | Переход жидкость – пар |
Дата добавления: 2014-11-20; просмотров: 265; Нарушение авторских прав

Мы поможем в написании ваших работ!