
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Состав и переработка органического топлива
План лекции:
1) Классификация топлива и его теплота сгорания.
2) Твердое топливо и его переработка.
3) Жидкое топливо.
4) Газовое топливо.
5) Охрана воздушного бассейна Земли.
Топливом называются вещества, которые при окислении кислородом воздуха, выделяют тепло, необходимое для поддержания определенной температуры. В настоящее время основным источником энергии на Земле является химическая энергия органического топлива. Топливо подразделяется по агрегатному состоянию на твердое, жидкое и газообразное, по способу получения — на естественное и искусственное.
К твердому виду топлива относятся каменный и бурый уголь, горючие сланцы, торф, а также дрова. К жидкому виду топлива относят нефть и продукты переработки топлива: бензин, керосин, мазут. К газовому виду топлива относятся природный газ и газообразные продукты переработки жидкого и твердого топлива.
Важнейшей характеристикой топлива является теплота сгорания. Теплотой сгорания вещества называется тепловой эффект реакции окисления кислородом элементов, входящих в состав этого вещества до образования высших оксидов.
В технике термохимические свойства топлива обычно характеризуются его удельной теплотой сгорания, которая равна количеству теплоты, выделяющемуся при сгорании 1 кг жидкого или твердого топлива и 1м3 газообразного топлива.
Основным компонентом твердого топлива, как видно из табл. 10, является углерод.
Таблица 10
Содержание углерода в твердых видах топлива и их удельная теплота сгорания
| Топливо | Массовая доля углерода, % | Удельная теплота сгорания, МДж/кг |
| Древесина | ||
| Торф | 19-24 | |
| Бурый уголь | ||
| Каменный уголь | ||
| Антрацит |
 Углерод входит в горючую часть, которая кроме него содержит водород, кислород и серу. К негорючей части топлива относят неорганические вещества, переходящие после сжигания топлива в золу и влагу. Влага снижает теплоту сгорания топлива, так как на ее испарение расходуется теплота. На нагревание золы также расходуется теплота.
Углерод входит в горючую часть, которая кроме него содержит водород, кислород и серу. К негорючей части топлива относят неорганические вещества, переходящие после сжигания топлива в золу и влагу. Влага снижает теплоту сгорания топлива, так как на ее испарение расходуется теплота. На нагревание золы также расходуется теплота.
 Для извлечения ценных компонентов и придания более удобной для использования вида твердое топливо подвергают химической обработке. Используются в основном три способа обработки твердого топлива.
Для извлечения ценных компонентов и придания более удобной для использования вида твердое топливо подвергают химической обработке. Используются в основном три способа обработки твердого топлива.
1. Пиролиз − сухая перегонка при 900-1100°С без доступа воздуха, в результате чего образуются газообразные и жидкие продукты и твердыйостаток (кокс). Кокс содержит 95 % (масс.) углерода и используется в металлургии для выплавки чугуна. Из жидких продуктов (каменноугольной смолы) получают ароматические соединения (бензол, фенол, нафталин), технические масла. Из газообразных продуктов извлекают аммиак, сероводород. Оставшийся коксовый газ используется как сырье для химического синтеза или как топливо. Из 1 т угля получают 750 кг кокса, 350 м3 коксового газа, 35 кг смолы, 10 кг бензола и 35 кг аммиака.
2. Частичное окисление (пароводяная конверсия), при которой раскаленный угль обрабатывают водяным паром:
С + Н2О пар = СО + Н2.
В результате образуется водяной газ (синтез-газ), состоящий из горючих веществ − оксида углерода СО и водорода Н2. Теплота сгорания водяного газа высока (12 МДж/ м3), так как оба его компонента – горючие газы.
3. Гидрогенизация – обработка 
 измельченного твердого топлива водородом в присутствии катализаторов при температуре 500°С и высоком давлении, в результате которой образуются жидкие и газообразные продукты: бензин, минеральные масла, метан.
измельченного твердого топлива водородом в присутствии катализаторов при температуре 500°С и высоком давлении, в результате которой образуются жидкие и газообразные продукты: бензин, минеральные масла, метан.
 Естественным жидким топливом является нефть. Она состоит в основном из смеси различных углеводородов. Теплота сгорания нефти достаточно высока и составляет 40-46 МДж/кг. Нефть обычно подвергают перегонке или крекингу, а также очищают от серы. При фракционной перегонке нефти при атмосферном давлении до температуры 360°С получают бензин, керосин и дизельное топливо. Остальная часть (мазут) либо применяется как топливо в паровых котлах или промышленных печах, либо подвергается перегонке подвакуумом (4-6 кПа). В результате получают масляные дистилляты, парафин и гудрон. Для увеличения выхода низкокипящих фракций крупные молекулы высококипящих фракций нефти расщепляют на более мелкие молекулы. Этот процесс называется кpeкингом. Различают термический и каталитический крекинг.
Естественным жидким топливом является нефть. Она состоит в основном из смеси различных углеводородов. Теплота сгорания нефти достаточно высока и составляет 40-46 МДж/кг. Нефть обычно подвергают перегонке или крекингу, а также очищают от серы. При фракционной перегонке нефти при атмосферном давлении до температуры 360°С получают бензин, керосин и дизельное топливо. Остальная часть (мазут) либо применяется как топливо в паровых котлах или промышленных печах, либо подвергается перегонке подвакуумом (4-6 кПа). В результате получают масляные дистилляты, парафин и гудрон. Для увеличения выхода низкокипящих фракций крупные молекулы высококипящих фракций нефти расщепляют на более мелкие молекулы. Этот процесс называется кpeкингом. Различают термический и каталитический крекинг.
 Газовое топливо– это:
Газовое топливо– это:  а) природный газ из газовых месторождений, в основном состоящий из метана (об. доля 85-95% ); б) попутные нефтяные газы, включающие метан (об. доля80%) и другие углеводороды (в основном С2-С5);
а) природный газ из газовых месторождений, в основном состоящий из метана (об. доля 85-95% ); б) попутные нефтяные газы, включающие метан (об. доля80%) и другие углеводороды (в основном С2-С5);  в) газы газовых конденсатов, находящиеся под высоким давлением
в) газы газовых конденсатов, находящиеся под высоким давлением
(10-60 МПа) и содержащие парообразные бензино-керосиновые фракции.
Природные газы используют как топливо (удельная теплота сгорания 31-38 МДж/м3) и как химическое сырье. Из природных газов извлекают также серу, благородные газы и другие вещества.
Практически нет ни одной отрасли народного хозяйства, в которой бы ни использовалось топливо. Наибольшее количество топлива расходуется электростанциями, транспортом, промышленными печами и аппаратами. На тепловых электростанциях используется твердое (уголь, сланцы и др.), жидкое и газовое топливо. Прежде основным видом жидкого топлива, применяемого на электростанциях и в промышленности, являлся мазут. На новых тепловых электростанциях в нашей стране нефтепродукты в качестве топлива практически уже не применяются.
Коэффициент использования топлива в промышленных печах и аппаратах, как правило, невелик, поэтому важнейшей задачей является снижение расхода топлива путем создания новых технологических процессов, новых аппаратов и печей, устранение потери топлива.
В двигателях внутреннего сгорания автотранспорта, локомотивов, самолетов и кораблей используется бензин, керосин и некоторые более тяжелые фракции. Энергия горения топлива в двигателях внутреннего сгорания превращается в механическую энергию. Мощность двигателя возрастает с увеличением степени сжатия топливно-воздушной смеси в цилиндрах двигателя. Однако при высоких степенях сжатия происходит детонация, т.е. горение принимает взрывной характер. Это отрицательно сказывается на работе двигателя. Детонацию можно предотвратить введением в топливо антидетонаторов, способствующих обрыву цепей в цепных реакциях горения. В качестве антидетонаторов обычно используется тетраэтилсвинец Рb (С2Н5)4. Однако свинец и его соединения токсичны (ПДК тетраэтилсвинца в рабочей зоне составляет всего 5∙10-4 мг/м3). При сжигании бензина соединения свинца попадают с выхлопами в окружающую среду. Например, содержание свинца в почве около автострады (рис. ) в десятки и сотни раз превышает фоновые (10 мг/кг). Все бензины ядовиты (ПДК 0,1-0,3 г/м3), особенно этилированные.
 В дизелях и газотурбинных установках используется дизельное топливо. Основным требованием, предъявляемым к этому топливу, является быстрое воспламенение и плавное горение. Для улучшения качества в дизельное топливо добавляются присадки. Дизельное топливо также токсично.
В дизелях и газотурбинных установках используется дизельное топливо. Основным требованием, предъявляемым к этому топливу, является быстрое воспламенение и плавное горение. Для улучшения качества в дизельное топливо добавляются присадки. Дизельное топливо также токсично.
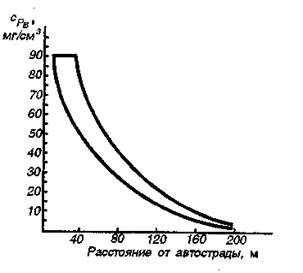
Рис. 25 Накопление свинца в почве в зависимости от расстояния от автострады
Сжигание органического топлива на электростанциях, в котельных, промышленных печах и двигателях внутреннего сгорания, а также при переработке руд и получении различных химических продуктов является причиной попадания вредных веществ в атмосферу.
 Суммарные антропогенные выбросы на нашей планете составляют в среднем (т/год): пыль и сажа − (8-16) ∙ 108, оксид углерода − (1-3) ∙ 108, оксиды серы − (8-15) ∙ 107, оксиды азота − (4-8,5) ∙ 107. Кроме того, в атмосферу поступают углеводороды, свинец, ртуть, мышьяк, летучие химические реагенты и продукты. Как видно из рис. 26, основная часть выбросов (до 21%) поступает от тепловых электростанций.
Суммарные антропогенные выбросы на нашей планете составляют в среднем (т/год): пыль и сажа − (8-16) ∙ 108, оксид углерода − (1-3) ∙ 108, оксиды серы − (8-15) ∙ 107, оксиды азота − (4-8,5) ∙ 107. Кроме того, в атмосферу поступают углеводороды, свинец, ртуть, мышьяк, летучие химические реагенты и продукты. Как видно из рис. 26, основная часть выбросов (до 21%) поступает от тепловых электростанций.
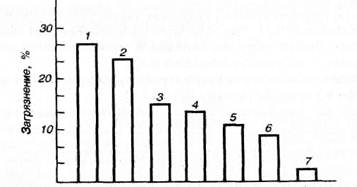
Рис. 26. Доли загрязнений атмосферы различными отраслями техники:
1– теплоэнергетика; 2–черная металлургия;
3– нефтепереработка; 4 – автотранспорт; 5 – цветная металлургия; 6 – производство стройматериалов;
7 – химическая промышленность
Продукты горения топлива зависят от его состава и условий сжигания. При горении органического топлива на электростанциях, в промышленных печах, двигателях внутреннего сгорания и других установках всегда образуются Н2О, СО2 и СО. Соотношение между СО2 и СО в продуктах горения зависит от ряда факторов и прежде всего от соотношения топлива и воздуха. Если подача воздуха недостаточна, то топливо сгорает неполностью, и в продуктах горения увеличивается воля СО и сажи, при этом КПД использования топлива понижается. В то же время большой избыток воздуха ухудшает эффективность ра 
 боты установок, так как при этом необходимы дополнительные затраты теплоты на подогрев воздуха. Поэтому должно соблюдаться оптимальное соотношение между топливом и воздухом.
боты установок, так как при этом необходимы дополнительные затраты теплоты на подогрев воздуха. Поэтому должно соблюдаться оптимальное соотношение между топливом и воздухом.
Кроме паров воды и оксидов углерода, продукты горения топлива содержат оксиды серы и азота.
Оксиды серы образуются по реакциям окисления серы и серосодержащих соединений:
S + О2 = SО2
SО2 + ½ О2 = SО3
 Основная часть оксидов азота поступает в атмосферу отавтотранспорта и тепловых электростанций. Оксиды азота образуются за счет окисления как азота воздуха, так и азота топлива. Реакция протекают по цепному механизму по схеме:
Основная часть оксидов азота поступает в атмосферу отавтотранспорта и тепловых электростанций. Оксиды азота образуются за счет окисления как азота воздуха, так и азота топлива. Реакция протекают по цепному механизму по схеме:
О2 + N2 → NО2 + N*
N* + О2 → NO + О*
N* + О* → NO*
Атомарный и молекулярный кислород образуют токсичный озон. В реакции окисления принимают участие радикалы, oбразующиеся при окислении или разложении топлива, например СН:
CH* + N2 → HCN + N*
OH* +N* → NO + H*
Химические процессы ускоряются под действием солнечных лучей (см. лекцию 7). Продукты горения топлива содержат также углеводороды, в частности бенз(а)пирен C20H12, обладающий канцерогенными свойствами (см. лекцию 13). В продуктах горения твердого топлива и мазута имеется значительная доля твердых веществ: золы и сажи.
Количество и состав продуктов горения зависят от состава исходного топлива и условий горения (табл. 11)
Таблица 11
Годовые выбросы (тыс. т) тепловой электростанции мощностью 1000 МВт
| Выброс | Вид топлива | ||
| Газ | Мазут | Уголь | |
| SО2 | 0,01 | 53,00 | 139,00 |
| NО2 | 12,10 | 22,00 | 20,90 |
| СО | - | 0,08 | 0,20 |
| Твердые частицы | 0,50 | 0,75 | 4,50 |
Как видно из табл. 11, при сжигании мазута и угля основными вредными выбросами являются оксиды серы и азота, при сжигании газа − оксиды азота. Кроме того, среди вредных выбросов электростанций, работающих на угле, могут быть ртуть, бериллий, свинец, кадмий, уран, хром, сурьма, ванадий, марганец и другие экологически опасные элементы.
На долю энергетики приходится более 70% всех выбросов оксидов серы и более 40% выбросов оксидов азота. Заметный вклад в загрязнение атмосферы вносит транспорт. В среднем автомобиль выбрасывает в атмосферу (кг/год): оксида углерода (II) − 135, оксидов азота − 25, углеводородов − 20, оксидов серы − 4, твердых частиц − 1,2. В настоящее время в мире эксплуатируются сотни миллионов автомобилей и число их непрерывно возрастает, особенно в крупных городах. Соответственно растут и вредные выбросы в атмосферу, в частности возникает фотохимический смог (см. лекцию 7).
В настоящее время антропогенные выбросы в атмосферу оказывают влияние не только на окружающую среду, но и на климат на Земле. К числу таких глобальных последствий относятся разрушение озонового слоя, «парниковый» эффект и кислотные дожди.
Кислотными дождями называются атмосферные осадки, содержащие кислоты (серную H2SO4 и азотную HNО3), которые образуются при взаимодействии оксидов серы и азота с водой в атмосфере:
SO2 + 1/2 O2 = SO3
SO3 + Н2О = H2SО4
2NО2+ Н2О = HNО3 + HNО2
Кислоты в виде мелких капель (размером 0,1-1,0 мкм) переносятся на большие расстояния, иногда на сотни километров, и выпадают в виде кислотных дождей. Попадая в почву, вода с низким значением рН (см. лекцию 17) может растворять соединения токсичных тяжелых металлов, а при недостаточной обменной емкости почвы подкисляет ее, что снижает урожай и вредит лесам. 

 Происходит заметное подкисление озер и прудов, которые стано
Происходит заметное подкисление озер и прудов, которые стано  вятся мертвыми. Кислотные дожди также вызывают коррозию металлов и разрушение мраморных и известковых конструкций и произведений искусства.
вятся мертвыми. Кислотные дожди также вызывают коррозию металлов и разрушение мраморных и известковых конструкций и произведений искусства.
«Парниковым» эффектом называется задерживание у поверхности инфракрасного (теплового) излучения Земли за счет увеличения концентрации диоксида углерода. СО2 прозрачен для солнечного света, но не пропускает в атмосферу тепловое излучение т.е. ведет себя подобно полиэтиленовой пленке в парнике (рис. 27, а). В связи с возрастанием темпов сжигания топлива растет концентрация диоксида углерода в атмосфере. Ожидается, что к 2050 г. концентрация СО2 удвоится по. равнению с 1978 г., что вызовет повышение средней температуры на Земле на 2,5-3,5 К и соответственно таяние ледников и повышение уровня Мирового Океана. По прогнозам специалистов уровень Океана в 2050 г. может подняться на 4-5 м, что приведет к затоплению огромных территорий. Аналогично СО2 ведет себя метан и другие углеводороды, которые поступают в атмосферу при добыче и переработке нефти и газа, а также из газовых криогидратов (клатратов) при таянии ледни-ков.
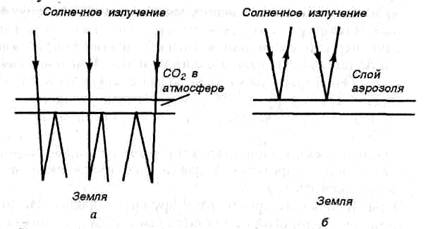

Рис. 27. Влияние СО2 (а) и аэрозолей (б) на прохождение и отражение солнечных и инфраккрасных лучей
До некоторой степени «парниковый» эффект компенсируется образованием аэрозолей (см. лекцию 22) твердых и жидких частиц, выбрасываемых в атмосферу в результате природных процессов и жизнедеятельности человека. Аэрозоли снижают способность атмосферы пропускать солнечный свет (см. рис. 27, б) и соответственно снижают среднюю температуру земной поверхности.
Защита воздушного бассейна от загрязнения стала одной из важных и сложных задач, стоящих перед человечеством. Решение ее осуществляется по трем направлениям: обезвреживание выбросов, изменение состава топлива и разработка новых методов преобразования энергии и новых технологий.
Для реализации первого направления тепловые электростанции оборудуются высокими трубами для рассеивания выбросов в более высокие слои атмосферы. Электростанции и металлургические заводы имеют золоуловители для удаления золы из продуктов горения, фильтры и адсорберы для сорбции некоторых газов и твердых частиц.
 Оксиды серы и азота, имеющие кислотный характер, нейтрализуются веществами основного характера. Для нейтрализации оксида серы используется известь, известняк, оксид магния и другие вещества:
Оксиды серы и азота, имеющие кислотный характер, нейтрализуются веществами основного характера. Для нейтрализации оксида серы используется известь, известняк, оксид магния и другие вещества:
2SО2 + СаСОз + ½ H2О = CaSО3 ∙ ½ H2О + СО2
SО2 + Са (ОН)2 = CaSО3 ∙ ½ H2О + ½ H2О
SО2 + MgO + 6H2О = MgSО3 ∙ 6H2О
SО2 + (NH4)2SО3 + H2О = 2NH4HSО3
Оксиды азота нейтрализуются известью, содой, аммиаком и другими веществами:
2NО2 + Na2CО3 = NaNО2 + NaNО3 + СО2
 4NО2 + 2Ca (OH)2 = Ca (NО3)2 + Ca (NО2)2 + 2H2О
4NО2 + 2Ca (OH)2 = Ca (NО3)2 + Ca (NО2)2 + 2H2О
2NО2 + 2NH4OH = NH4NО3 + NH4NO2 + H2О
Оксиды азота и серы обезвреживаются также методом каталитического восстановления, например:
4NO + СН4 = 2N2 + СО2 + 2Н2О
2NО2 + СН4 = N2 + CO2 + 2Н2О
Диоксид серы и оксид углерода (II) можно окислить на катали заторах:
SO2 + ½ О2 = SО3
SО3 + Н2О = Н2 SО4
СО + ½ О2 = СО2

 Для окисления оксида углерода (II) и восстановления оксидов азота (NO и NО2) в автомобилях предложены катализаторы, которые могут устанавливаться в выхлопных трубах и представляют собой пористую насадку с катализатором, например, платиной или палладием и родием. Газовые выбросы можно также очищать методом адсорбции (см. лекцию 8) на активированном угле, силикагелях, цеолитах и других адсорбентах.
Для окисления оксида углерода (II) и восстановления оксидов азота (NO и NО2) в автомобилях предложены катализаторы, которые могут устанавливаться в выхлопных трубах и представляют собой пористую насадку с катализатором, например, платиной или палладием и родием. Газовые выбросы можно также очищать методом адсорбции (см. лекцию 8) на активированном угле, силикагелях, цеолитах и других адсорбентах.
Сущность разрабатываемых в настоящее время энергохимических методов использования топлива заключается в изменении состава топлива, то есть в предварительной химической переработке топлива, очистке от серы и разделения его на фракции. Некоторые фракции могут служить ценным сырьем для химической промышленности, а другие фракции − топливом для электростанций. Очищенное топливо при горении будет давать значительно меньше вредных выбросов.
Наиболее кардинальным решением проблемы защиты воздушного бассейна является разработка новых методов преобразования энергии и новых машин, обеспечивающих безвредные выбросы, а также применение менее вредных веществ.
Так, например, происходит замена галогеносодержащих фреонов (ССl2F2) (см. лекцию 12) на новые соединения, не содержащие хлора (например, СН2F2), и таким образом, не разрушающие озонового слоя в верхних слоях атмосферы.
Существенного уменьшения загрязнение воздушного бассейна можно достичь, если осуществить идеи водородной энергетики. Стоимость передачи энергии в химической форме (в виде газа) значительно ниже стоимости передачи электроэнергии. В качестве носителя энергии может быть использован водород. В настоящее время ведутся широкие исследования будущих энергетических систем, в которых передача и распределение энергии будут осуществляться с помощью водорода. Применение водорода значительно снизит уровень загрязнения атмосферы, так как при его окислении образуется безвредный продукт − вода. Природные запасы соединений водорода огромны. Водород легко вступает в химические реакции, при его окислении выделяется большое количество теплоты. Поэтому водород может найти широкое применение в промышленности и быту, для синтеза различных соединений, освещения, отопления и охлаждения, приготовлении пищи и для получения электроэнергии с помощью электрохимических генераторов.
Существует большое количество способов получения водорода. Наиболее широко в настоящее время применяются способы пароводяной конверсии метана или угля:
СН4 + Н2О = 3Н2 + СО
С + Н2О = Н2 + СО
Одним из основных методов получения водорода в будущем рассматривается электролиз на атомных электростанциях. Кроме водорода выделяется и кислород, который также может быть использован в промышленности и быту. Кроме электролитического, рассматриваются существуют фотохимические методы получении водорода.
Таким образом, водородную энергетическую систему с учетом различных способов получения можно представить схемой:
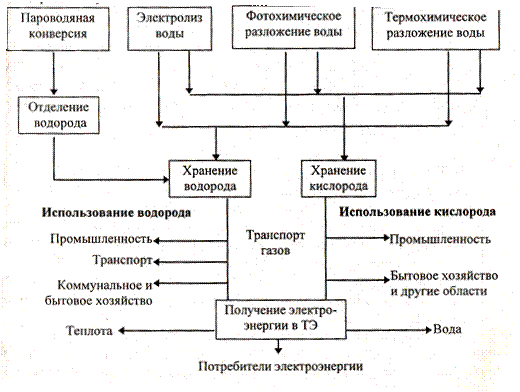
Новое направление в энергетике − электрохимическая энергетика − включает в себя генерацию и накопление электрической энергии. Генерация электроэнергии происходит в устройствах, называемых топливными элементами (ТЭ), в которых токообразующей реакцией служит окисление водорода:
2Н2 + О2 = Н2О
В ТЭ с щелочным электролитом могут быть использованы лишь чистые водород и кислород, поэтому они пока нашли применение только в космосе. В остальных ТЭ на анод может подаваться как чистый, так и технический водород, а также смесь Н2, СО2 и Н2О. Дли всех ТЭ вредными примесями, отравляющими катализаторы, являются соединения серы, в низко- и среднетемпературном ТЭ (до 200°С) также СО. В последние годы разрабатываются ТЭ с прямым окислением метанола, который подается на анод. На катоде ТЭ восстанавливается кислород воздуха.
Для непрерывной работы ТЭ необходимы подача реагентов, отвод продуктов реакции и теплоты и система автоматики. Батарея ТЭ вместе со вспомогательными устройствами составляют электрохимический генератор.
В ТЭ окислитель и топливо пространственно разделены, поэтому даже при высоких температурах образуется значительно меньше оксидов азота и СО, чем в тепловых машинах. Выброс вредных компонентов из электрохимических энергоустановок на 1,5-2 порядка ниже, чем из тепловых машин. Электрохимические энергоустановок можно устанавливать непосредственно около потребителя.
Одним из наиболее кардинальных решений проблемы снижения вредных выбросов транспортных устройств является замена двигателя внутреннего сгорания на экологически чистые устройства, например, батареи аккумуляторов или электрохимические установки, то есть создание электромобиля.
Выводы:
1. Органические соединения являются основным источником энергии на Земле. Органическое топливо по агрегатному состоянию делится на твердое, жидкое и газообразное, по происхождению – на природное и искусственное.
2.  При химической обработке твердого топлива получают ценные газообразные продукты, применяемые в органическом синтезе и различных областях техники.
При химической обработке твердого топлива получают ценные газообразные продукты, применяемые в органическом синтезе и различных областях техники.
3. Тепловые электростанции, двигатели внутреннего сгорания, металлургические и другие заводы выбрасывают в атмосферу огромное количество вредных газов (оксидов азота, серы, оксида углерода (II)). Увеличение эффективности мер по их нейтрализации невозможно без создания новых технологий, развития водородной и электрохимической энергетики, создания электромобиля.
Контрольные вопросы:
1. Назовите основные виды органического топлива и продукты его переработки.
2. Рассчитайте удельную теплоту сгорания метанола при 298К и стандартных состояниях веществ.
3. Охарактеризуйте глобальные последствия воздействия вредных антропогенных выбросов в атмосферу.
4. Как решается в современных условиях задача защиты воздушного бассейна Земли от загрязнений?
5. В газовых выбросах присутствуют диоксид серы, углеводороды, фенол, пары ртути. Предложите способы очистки газа от этих примесей.
6. Используя табл. 11, рассчитайте годовую потребность в Са(ОН)2 для нейтрализации оксида серы (IV) на ТЭС, работающей на мазуте.
Литература:
1. Глинка, Н.Л. Общая химия: Учеб. пособие для вузов / Н.Л. Глинка. – М.: Интеграл-Пресс, 2002. – Гл. ХV, §§ 158 – 159, с. 446 – 450.
2. Коровин, Н.В. Общая химия: Учеб. для технич. направл. и спец. вузов / Н.В. Коровин. – М.: Высшая школа, 2006. –§ 13.4, c. 439 – 446, § 15.2,
с. 479 – 490.
| <== предыдущая страница | | | следующая страница ==> |
| | | БОРЬБА РУСИ В XIII в. ПРОТИВ ИНОЗЕМНЫХ НАШЕСТВИЙ |
Дата добавления: 2014-11-20; просмотров: 501; Нарушение авторских прав

Мы поможем в написании ваших работ!