
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Метод валентных связей
ХИМИЧЕСКАЯ СВЯЗЬ. СТРОЕНИЕ ВЕЩЕСТВА
Л е к ц и я № 4
Энгельс – 2014 г.
СОДЕРЖАНИЕ
Введение
1. Общие положения учения о химической связи. Ионная связь.
2. Метод валентных связей.
3. Металлическая и водородная связи.
Заключение
ЛИТЕРАТУРА
Основная литература:
1. Габриэлян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриэлян, И.Г.Остроумов. – М.,2013.
2. Габриэлян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учеб. заведений / О.С. Габриэлян, Г.Г.Лысова. – М.,2012.
3. Габриэлян О.С. Практикум по общей и неорганической химии: учеб. пособие для студ. сред. проф. учеб. заведений / О.С. Габриэлян, И.Г.Остроумов, Дорофеева Н.М.– М.,2012.
4. Габриэлян О.С. Химия 10 класс. Профильный уровень: учеб. для общеобразовательных учреждений / О.С. Габриэлян, Ф.Н.Маскаев, С.Ю.Пономарёв, В.И.Теренин. – М.,2010.
5. Габриэлян О.С. Химия 10 класс. Базовый уровень: учеб. для общеобразовательных учреждений – М.,2009.
Дополнительная литература
6. Габриэлян О.С. Химия 11 класс. Профильный уровень: учеб. для общеобразовательных учреждений / О.С. Габриэлян, Г.Г.Лысова – М.,2006.
7. Габриэлян О.С. Химия 11 класс. Базовый уровень: учеб. для общеобразовательных учреждений.– М.,2006.
8. Габриэлян О.С. Химия: орган. Химия: учеб. для 10 кл. общеобразовательных учреждений с углубленным изучением химии / О.С. Габриэлян, И.Г.Остроумов, А.А.Карпова. – М.,2005.
9. Габриэлян О.С. Общая химия: учеб. для 11 кл. общеобразовательных учреждений с углубленным изучением химии / О.С. Габриэлян, И.Г.Остроумов,С.Н.Соловьёв, Ф.Н.Маскаев. – М.,2005.
НАГЛЯДНЫЕ ПОСОБИЯ И ПРИЛОЖЕНИЯ:
Схемы № 1, 11 – 12
1. Периодическая система элементов Д.И. Менделеева.
11. Изменение потенциала энергии системы при образовании молекул водорода.
12. Характеристика химических связей.
ВВЕДЕНИЕ
Свойства веществ зависят не только от состава, но и от типа химической связи между атомами.
Химическая связь - взаимодействие между атомами в процессе образования веществ.
Вопрос о природе химической связи – один из основных в химии.
Первая попытка создания теории химической связи была предпринята в начале 19 века. Причина объединения атомов в молекулу – силы тяготения. Чем тяжелее атомы, тем прочнее связь Бергман (Швеция), Бертолле (Франция).
В 1810 г. появилась электрохимическая теория Я.Берцеллиус (Швеция). Каждый атом имеет два полюса (+) и (–), причем у одних атомов преобладает (+), у других – (–). Магний – электроположительный, кислород – электроотрицательный. Они притягиваются и образуют соединение – MgO. Если происходит только частичная компенсация зарядов, то продукт реакционноспособен и возможна следующая реакция:
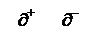 |
Мg + СО2 ® МgCO3
Эта теория существовала недолго, так как не объясняла существование прочных молекул Н2, Cl2 или интергалогенных соединений (JCl).
В 1852 году английский исследователь Франкланд ввел понятие валентности (атомности). Валентность выражает способность атома данного элемента вступать в соединение с определенным числом атомов другого элемента. Приняв валентность водорода за единицу, можно считать, что валентность других элементов является числом, показывающим, с каким числом атомов водорода (или другого одновалентного элемента) может соединяться атом данного элемента.
А.М.Бутлеров в 1861 году предложил теорию химического строения: соединение атомов происходит в соответствии с их валентностью и в определенном порядке. Определенный порядок атом в молекуле называется химическим строением.
Купер (Шотландия) в 1868 году отождествил одну валентность с одинарной химической связью, которую атом может образовать, вступая в химическое соединение. Предложено обозначать ее в виде валентного штриха.
Однако вопрос о силах, которые ответственны за образование валентных связей между атомами, оставался невыясненным.
Перейти к рассмотрению этой важнейшей проблемы химии удалось лишь после того, как было установлено, сложное строение атомов элементов и была создана теория строения их электронных оболочек.
Общие положения учения о химической связи.
Ионная связь
Два ученых: Коссель (Германия) и Льюис (США) в 1916 г. независимо друг от друга обратили внимание на то, что
- электронные конфигурации s2 и s2p6 атомов инертных газов являются особенно прочными (дублет, октет) и энергетически выгодными;
- атомы элементов при взаимодействии стремятся построить свой внешний энергетический уровень аналогично инертным газам;
- электронная конфигурация s2 и s2p6 может быть построена путем перераспределения электронов взаимодействующих атомов, в результате чего образуется химическая связь.
Однако механизм электронных процессов при химическом взаимодействии атомов элементов может быть разным.
Ионная связь. Теория Косселя
Перераспределение электронов внешнего уровня атомов до конфигурации s2 или s2p6 в соответствии с представлениями Косселя, осуществляется путем передачи электронов (отрыв - присоединение):
- или потерей всех электронов внешнего уровня, при этом обнажается предпоследний электронный уровень, имеющий конфигурацию s2p6 или s2;
- или присоединением одного или нескольких электронов до завершения энергетического уровня (s2 или s2p6).
Какой из этих способов осуществляется определяется электроотрицательностью взаимодействующих атомов. Более электроотрицательный атом присоединяет электроны, а менее электроотрицательный атом отдает их.
После передачи электронов образуются противоположно заряженные ионы, которые притягиваются друг к другу за счет сил электростатического притяжения, образуя химическую связь.
Такая связь получила название: ионная, гетерополярная, электровалентная.
Пример образования связи в молекуле LiF.
Запишем БЦЭФ и ГЭФ атомов лития и фтора
| Li0 | 1s22s1 | F0 | 1s22s22p5 | |||||||
 2 2
| ||||||||||
Запишем эти формулы после передачи электрона от лития ко фтору
 |
| LiÅ | 1s22s0 | F | 1s22s22p6 | |||||||
Образовавшиеся ионы притягиваются, образуя химическую связь.
Метод валентных связей
Застройка внешнего энергетического уровня до конфигурации s2 или s2p6, в соответствии с представлениями Льюиса, осуществляется путем обобществления электронов взаимодействующих атомов с образованием общих электронных пар.
Такую связь называют ковалентной, гомеополярной, атомной, парноэлектронной.
Пример образования молекул H2, Cl2, O2. (На самоподготовке изобразить образование связей в молекулах N2 и HCl).
Сначала записывают БЦЭФ и ГЭФ взаимодействующих атомов, а затем объединяют между собой орбитали, за счет которых образуются связи.
Н2
Н0 БЦЭФ Н0
1s1 1s1
 |
|
 Н Н
Н Н

Н2
Cl2
Cl БЦЭФ Cl
1s22s22p63s235
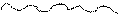 |
| ¯ | ¯ | ¯ | | ¯ | ¯ | ¯ | ¯ | ||||||
| ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ||||||
 ¯ ¯
| 
|
| ¯ |
|
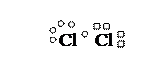 |
|
|

Cl – Cl
Cl2
О2
O0 БЦЭФ О0
 1s22s22p4
1s22s22p4
 |
| ¯ | ¯ | | | ¯ | ¯ | ¯ | ¯ | ||||
 ¯ ¯
| 
| ¯ |
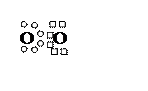
|
|
|
|
 |
О = О
О2
Существует два способа (механизма) обобществления электронов:
- обменный механизм (см. примеры выше);
- донорно-акцепторный.
Во втором случае при образовании химической связи один атом представляет пару электронов (донор), а другой атом – свободную орбиталь. Например: образование молекулы водорода из гидрид-иона и протона водорода.
 |  | ||
 Н Н
Н Н
 |

 | |||
 | |||
Н + Н = Н2
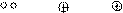 |
NH3 + Н ® NH4
Современное учение о химической связи основано на квантовомеханических представлениях. Для описания химической связи в настоящее время широко используются два метода: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
Таким образом, в соответствии с методом ВС ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит одновременно двум атомам. Сами же атомы сохраняют свою индивидуальность.
Ковалентная химическая связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
В широком смысле слова ковалентная связь – это химическая связь между атомами, осуществляемая путем обобществления электронов. Ковалентную связь можно рассматривать как универсальный, самый распространенный тип химической связи.
Для точного описания состояния электрона в молекуле необходимо решить уравнение Шредингера для соответствующей системы электронов и ядер, задавшись условием минимума энергии. Однако, в настоящее время решение уравнения Шреденгера возможно лишь для самых простых систем. Впервые приближенный расчет волновой функции электрона был произведен в 1927 году Гейтлером и Лондоном для молекулы водорода. В результате проведенной работы они получили уравнение, связывающее потенциальную энергию системы с расстоянием между ядрами двух атомов водорода. При этом оказалось, что результаты расчетов зависят от того, одинаковы или противоположны по знаку спины обоих электронов. При параллельных спинах сближение атомов приводит к непрерывному возрастанию энергии системы. При противоположно направленных спинах сближение атомов до некоторого расстояния r0 сопровождается снижением энергии системы, после чего она вновь начинает возрастать (рисунок 1).
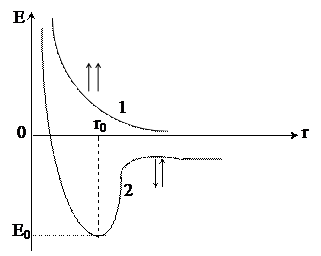 |
Рис. 1. Зависимость энергии системы из двух атомов водорода от
межядерного расстояния в случае электронов
с параллельными спинами (1) и антипараллельными (2) спинами
Таким образом, в первом случае образования химической связи по энергетическим причинам не происходит, в случае же противоположно направленных спинов электронов образуется молекула Н2 – устойчивая система из двух атомов водорода, расстояние между ядрами которых составляет r0.
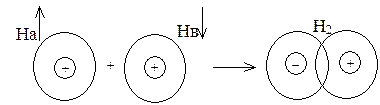 |
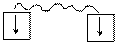
Это расстояние r0 существенно меньше удвоенного атомного радиуса (для молекулы водорода – соответственно 0,074 и 0,106 нм), следовательно, при образовании химической связи происходит взаимное перекрывание электронных облаков, реагирующих атомов (рис. 2).
Рис. 2. Схема перекрывания электронных облаков при образовании
молекулы водорода
Вследствие перекрывания облаков электронная плотность между ядрами повышается, при этом возрастают силы притяжения между этой областью отрицательного заряда и положительно заряженными ядрами взаимодействующих атомов. Возрастание сил притяжения сопровождается выделением энергии, что и приводит к образованию химической связи.
| <== предыдущая страница | | | следующая страница ==> |
| Вопрос 2.4. Рамочные антенны | | | Основные характеристики ковалентной связи |
Дата добавления: 2014-11-20; просмотров: 396; Нарушение авторских прав

Мы поможем в написании ваших работ!