
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ПОСТУЛАТ ПЛАНКА.ВЫЧИСЛЕНИЕ АБСОЛЮТНОЙ ЭНТРОПИИ
В 1912 г. М. Планк высказал не связанное ни с первым ни со вторым законом термодинамики и экспериментально недоказуемое утверждение (постулат),что при абсолютном нуле энтропия чистого кристаллического вещества равна нулю. В отличие от первого и второго законов термодинамики из постулата Планка нельзя вывести новые фундаментальные понятия. Однако предсказание lim S = 0 настолько хорошо согласуется с опытом и настолько важно, что постулат Планка называют третьим законом термодинамики.
Формулировка - любое вещество имеет определенную положительную энтропию, но при абсолютном нуле энтропия может стать равной нулю и она равна нулю для чистых правильно образованных кристаллических веществ.
Третий закон оправдан теоретическими соображениями. Согласно уравнения Больцмана S = k lnW S = 0 ,когда W = 1.Значению W = 1 отвечает единственно возможное макросостояние - идеально правильно построенный кристалл, в кристаллической решетке которого атомы занимают узлы в строгом соответствии с геометрическими законами. В реальных кристаллах вследствие их образования и охлаждения в неравновесных условиях имеются различные дефекты структуры. Поэтому энтропия реальных кристаллов при 0 К должна быть больше нуля. Фактически энтропия реальных кристаллов мало отличается от нуля и этой разницей пренебрегают без ущерба для термодинамических расчетов.
Третий закон используется при вычислениях абсолютных энтропий простых и сложных веществ.
Абсолютной энтропией называется энтропия, отсчитанная относительно нуля К.
SТ = SТ – SО = 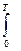 CР ТВ
CР ТВ 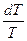 +
+ 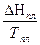 +
+ 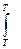 СР Ж
СР Ж 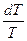 +
+ 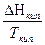 +
+
+ 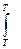 СР Г
СР Г 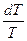 = S
= S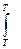 СРi
СРi 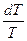 + S
+ S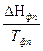
С целью сравнения и табулирования энтропии веществ относят к стандартному состоянию, температуре 298 К и обозначают S0298.
Стандартные энтропии удобны для расчета изменения энтропии в химических реакциях по формуле
DS = S (ni S0298)кон - S(ni S0298)исх
DSТ = DS298 + 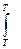 DCР
DCР 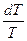
| <== предыдущая страница | | | следующая страница ==> |
| ИЗМЕНЕНИЕ ЭНТРОПИИ В РАЗЛИЧНЫХ ПРОЦЕССАХ | | | УРАВНЕНИЕ ГИББСА-ГЕЛЬМГОЛЬЦА |
Дата добавления: 2014-03-11; просмотров: 520; Нарушение авторских прав

Мы поможем в написании ваших работ!