
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
УРАВНЕНИЕ ГИББСА-ГЕЛЬМГОЛЬЦА
ПОТЕНЦИАЛ)
ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА (ИЗОХОРНО-ИЗОТЕРМИЧЕСКИЙ
ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
Работа равновесного процесса максимальна - Wмаx
dWmax = TdS - dU = -d(U - TS)
U - TS = A(F) – Энергия Гельмгольца (изохорно-изотермический потенциал)
Wmax = -DA
dA = dU - TdS - SdT
dW £ TdS - dU
dU £ TdS - PdV
dA £ TdS - PdV - TdS - SdT £ -SdT - PdV
(¶A/¶T)V £ -S
(¶A/¶T)T £ - P
Энтропия служит мерой убыли энергии Гельмгольца с увеличением температуры, а давление - мерой ее убыли с увеличением объема системы.
(¶A)V,T £ 0
Энергия Гельмгольца системы, находящейся при постоянных V и Т не изменяется при равновесных процессах и убывает при неравновесных процессах. Направление неравновесного процесса определяется убылью энергии Гельмгольца.
1.15 ЭНЕРГИЯ ГИББСА (ИЗОБАРНО-ИЗОТЕРМИЧЕСКИЙ
ПОТЕНЦИАЛ)
dU = dQ - PdV - dWn
dWn = - dU + TdS - PdV
dWn = - (dU - TdS + PdV) = - d(U - TS + PV) = -dG
U - TS + PV = G - Энергия Гиббса
Wn = - DG
G = U - TS + PV = H - TS = A + PV
dG £ dA + PdV + VdP £ -SdT - PdV + PdV + VdP
dG £ - SdT + VdP
(¶G/¶T)P £ -S
(¶G/¶P)T £ V
(¶G)P,T £ 0
Энергия Гиббса при постоянных Р и Т уменьшается при неравновесных процессах и остается постоянной при равновесных процессах. Равновесное состояние при данных Р и Т соответствует минимуму энергии Гиббса.
DG < 0 процесс возможен
DG > 0 процесс невозможен
DG = 0 процесс равновесен
A = U - TS = U + T(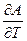 )V
)V
DA = DU + T(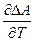 )V
)V
Wmax = - DU + T(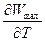 )V
)V
G = H - TS = H + T(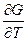 )P
)P
DG = DH + T(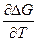 )P
)P
Wn = - DH + T(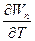 )P
)P
| <== предыдущая страница | | | следующая страница ==> |
| ПОСТУЛАТ ПЛАНКА.ВЫЧИСЛЕНИЕ АБСОЛЮТНОЙ ЭНТРОПИИ | | | ХИМИЧЕСКИЙ ПОТЕНЦИАЛ.ЛЕТУЧЕСТЬ |
Дата добавления: 2014-03-11; просмотров: 462; Нарушение авторских прав

Мы поможем в написании ваших работ!