
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Однокомпонентные гетерогенные системы. Уравнение Клапейрона - Клаузиуса
Однокомпонентная гетерогенная система состоит из индивидуального вещества, которое может существовать в различных агрегатных состояниях или полиморфных модификациях.
Рассмотрим равновесный процесс перехода вещества из фазы 1 в фазу 2. В условиях равновесия молярная энергия Гиббса вещества в первой и второй фазах равны:
G1 = G2 (4.5)
Изменение температуры и давления вызовет изменение энергии Гиббса в каждой фазе [см. (2.53)]:
dG1 = - S1dT + V1dP (4.6)
dG2 = - S2dT + V2dP, (4.7)
где V1, V2 – молярные объёмы, а S1, S2 – молярные энтропии вещества в соответствующих фазах. При равновесии между фазами dG1=dG2.
Следовательно,
(S2 – S1)dT = (V2 - V1)dP, (4.8)
откуда
 . (4.9)
. (4.9)
Изменение энтропии при температуре фазового перехода
 , (4.10)
, (4.10)
где ΔНФ.П. молярная теплота фазового перехода.
При подстановке (4.10) в уравнение (4.9) получим уравнение
Клапейрона - Клаузиуса:
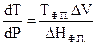 (4.11)
(4.11)
Уравнение Клапейрона – Клаузиуса характеризует зависимость температуры фазового перехода от внешнего давления в однокомпонентной системе. В данной форме уравнение применимо к любому двухфазному равновесному переходу.
Для процесса плавления dТ/dР – изменение температуры плавления при изменении давления на единицу. Поскольку плавление всегда сопровождается поглощением тепла, то знак производной dТ/dР зависит от знака ΔV= Vж – Vтв, то есть изменения объёма при плавлении (следует помнить, что при определении изменения объёма всегда вычитают из конечного значения параметра – начальное). Чаще всего, Vж > Vтв, поэтому с увеличением давления температура плавления вещества повышается. Реже наблюдается обратная закономерность: ΔV < 0 и с ростом давления температура плавления понижается. Таких веществ не много. Это, например, вода ( при давлениях ниже 2200 атм), висмут и некоторые другие.
Для процесса испарения жидкости уравнению Клапейрона - Клаузиуса можно придать другой вид. Часто можно пренебречь объемом жидкой фазы по сравнению с объемом пара и считать DV=Vп. Например, при 273,15 К для воды Vп = 22400 см3, а Vж = 18 см3. Если насыщенный пар подчиняется уравнению состояния идеальных газов, то Vп = RT/P (для 1 моля идеального газа) и из (4.11) получим
 или
или
 (4.12)
(4.12)
Уравнение (4.12) тоже называется уравнением Клапейрона-Клаузиуса.
Здесь следует снова обратить внимание на то, что под знаком логарифма оказывается величина, имеющая размерность. Не приводя здесь преобразований этой величины в безразмерную, отметим только, что для соблюдения правил применения математического аппарата к вычислениям физических параметров, будем считать, что под знаком логарифма и в этом случае (как и в предыдущем разделе курса, например см. (2.77) и далее) мы подставим относительное давление, то есть давление, отнесённое к Р0 – стандартному давлению. Если давление выражено в атмосферах, то Р0 = 1 атм.
Для равновесия кристаллы ↔ пар, зависимость давления насыщенного пара вещества, равновесного с кристаллами, от температуры выражается аналогичным уравнением. Тогда вместо DНисп. следует записать DНвозг. –молярная теплота возгонки, Т – температура возгонки (или сублимации).
Проинтегрируем уравнение (4.12) в пределах от состояния 1 до состояния 2, считая DНисп. величиной постоянной (не зависящей от температуры):
 (4.13)
(4.13)
Или неопределенный интеграл:
 (4.14)
(4.14)
Физический смысл постоянной интегрирования В:  , где DSисп. - изменение энтропии при образовании 1 моля пара.
, где DSисп. - изменение энтропии при образовании 1 моля пара.
Зависимость  линейна, угловой коэффициент ее составляет - DНисп./2,3R. Для фазовых превращений конденсированных фаз (например, вода↔лед) или полиморфных превращений (например, Sромб↔Sмонокл.) температурный коэффициент dP/dT характеризует возникающее давление при изменении температуры на 1 градус. Уравнения Клапейрона-Клаузиуса широко используются при расчете фазовых равновесий.
линейна, угловой коэффициент ее составляет - DНисп./2,3R. Для фазовых превращений конденсированных фаз (например, вода↔лед) или полиморфных превращений (например, Sромб↔Sмонокл.) температурный коэффициент dP/dT характеризует возникающее давление при изменении температуры на 1 градус. Уравнения Клапейрона-Клаузиуса широко используются при расчете фазовых равновесий.
Пример.
На вершине горы атмосферное давление Р = 634 мм рт. ст. При какой температуре закипит вода в этих условиях? Известно, что теплота испарения воды DНисп. = 40587 Дж/моль, и при Р1= 760 мм рт. ст. температура кипения воды Т1=373 К. Подставив эти данные в уравнение (4.13), рассчитаем Т2. При заданных условиях вода закипит при Т=368 К, или при 95°С.
| <== предыдущая страница | | | следующая страница ==> |
| Понятие о физико-химическом анализе. Термический анализ | | | Фазовые диаграммы однокомпонентных гетерогенных систем |
Дата добавления: 2014-10-02; просмотров: 574; Нарушение авторских прав

Мы поможем в написании ваших работ!