
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ.ЛЕТУЧЕСТЬ
ХАРАКТЕРИСТИЧЕСКИЕ ФУНКЦИИ
Для внутренней энергии можно записать
dU £ TdS - PdV
(¶U)S,V £ 0 -изохорно-изоэнтропный потенциал
При всех неравновесных изохорно-изоэнтропных процессах внутренняя энергия убывает, когда величина U достигает минимума система приходит в равновесие.
Для энтальпии
dH = d(U + PV) £ TdS + VdP
(¶H)s,p £ 0 - изобарно-изоэнтропный потенциал
dU £ TdS - PdV
dH £ TdS + PdV
dA £ -SdT - PdV
dG £ -SdT + PdV
Эти выражения образуют замкнутую группу, в которой две пары переменных T и S (параметры, связанные с теплотой) и Р и V (параметры, связанные с работой) дают все возможные сочетания.
Частными производными четырех функций при данном характерном для каждой наборе независимых переменных являются основные параметры состояния системы P,V,S и Т. Отсюда вытекает важное свойство этих функций - через каждую из этих функций и ее производные можно выразить в явной форме любое термодинамическое свойство системы. Каждая функция
U = f(S,V) H = f(S,P) A = f(V,T) G = f(P,T)
дает таким образом термодинамическую характеристику системы. Поэтому указанные функции называются характеристическими.
Все, что сказано было об термодинамических потенциалах, относилось к закрытой системе, в которой масса сохраняется постоянной. При изучении растворов и гетерогенных систем, состоящих из двух или более веществ, необходимо рассматривать открытые системы, где состав и масса могут быть непостоянными вследствие химических реакций и других процессов.
Энергия Гиббса в этом случае является функцией не только Т и Р, но и количеств n1,n2,...ni молей компонентов.
G = f(T,P,n1, n2,....ni)
dG = (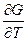 )Р,п dT + (
)Р,п dT + (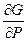 )т,ni dP + (
)т,ni dP + (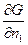 )p,т,nj dn1+ +.(
)p,т,nj dn1+ +.(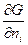 )p,т,njdni
)p,т,njdni
ni - постоянное число молей всех компонентов
nj - постоянное число молей всех компонентов, кроме одного, изменение которого рассматривается
(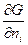 )p,т,ni = mi - химический потенциал
)p,т,ni = mi - химический потенциал
Химический потенциал, частная производная энергии Гиббса по массе i-того компонента при постоянных Р и Т и массах остальных компонентов.
dGP,T = m1 dn1 + m2 dn2 + ....+ mI dni
dGP,T = S mI dni
Для равновесия S mi dni= 0
Любые равновесные свойства газов можно выразить через химический потенциал
При Т = const
dG = VdP
dm = VdP
m = 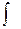 VdP + C
VdP + C
V = 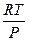
dm = 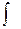 RT
RT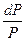 = RT
= RT 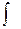 dlnP
dlnP
m = m0+ RT lnP
m0 - стандартный химический потенциал
m2 - m1 = RT ln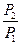
Химический потенциал реального газа можно вычислить двумя способами. Первый способ состоит в том, что для решения уравнения объем газа выражают через давление, используя одно из уравнений реального газа.
(P + 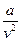 ) (v - b) = RT - уравнение Ван-дер Ваальса
) (v - b) = RT - уравнение Ван-дер Ваальса
Другой способ предложил Льюис. При этом используются те же выражения что и для вычисления химического потенциала идеального газа, но вместо
давления в них подставляют переменную - летучесть или фугитивность - f.
dm = RTd lnf
m = m* + RT lnf
m2 - m1 = Dm = RT ln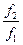
Отношение летучести к давлению реального газа называется коэффициентом летучести
g = 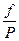
f = g P
Коэффициенты летучести вычисляют на основе принципа соответственных состояний. Он заключается в том, что при одинаковых приведенных параметрах все газы обладают приблизительно одинаковыми свойствами. Приведенным параметром называется отношение этого параметра к его критическому значению.
p = 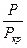
t = 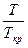
В соответствие с этим принципом при одинаковых приведенных параметрах газы обладают приблизительно одинаковыми коэффициентами летучести. Коэффициент летучести по этому способу определяют при помощи графика
lgg - lgp при разных значениях приведенной температуры.
| <== предыдущая страница | | | следующая страница ==> |
| УРАВНЕНИЕ ГИББСА-ГЕЛЬМГОЛЬЦА | | | ХИМИЧЕСКОЕ РАВНОВЕСИЕ.ЗАКОН ДЕЙСТВУЮЩИХ МАСС |
Дата добавления: 2014-03-11; просмотров: 356; Нарушение авторских прав

Мы поможем в написании ваших работ!