
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ХИМИЧЕСКОЕ РАВНОВЕСИЕ.ЗАКОН ДЕЙСТВУЮЩИХ МАСС
1799 - Бертолле 1864 - Гульдберг и Вааге
При постоянной температуре отношение произведений равновесных концентраций продуктов реакции в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ в степени их стехиометрических коэффициентов есть величина постоянная.
Кинетический вывод
n1 A1 + n2 A2 = n3 A3 + n4 A4
v1 =k1 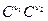 v2 = k2
v2 = k2 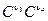
При равновесии v1 = v2
k1 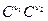 = k2
= k2 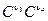
K = 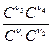
термодинамичеcкий вывод
Smidni = 0
mi = mi0 + RT lnPi
n3m3 + n4m4 - n1m1 - n2m2 = (n3m30 + n4m40 - n1m10 - n2m20) +
RT (n3lnP3 + n4lnP4 - n1 lnP1 - n2 lnP2) = 0
ln 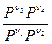 = -
= - 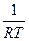 (n3m30 + n4m40- n1m10 - n2m20) = lnKp
(n3m30 + n4m40- n1m10 - n2m20) = lnKp
Kp = 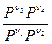
Константа равновесия может выражаться через различные величины
через давление - Kp , через концентрации - Kc , через мольные доли - KN,
через активности - Ka .
PV = nRT
P = n/V RT
P = CRT
Kp= 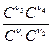 (RT)(n3+ n4-n1-n2)
(RT)(n3+ n4-n1-n2)
Kp = Kc (RT)Dn
Pi = P Ni
Kp = 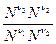 P(n3+n4-n1-n2)
P(n3+n4-n1-n2)
Kp = KN PDn
| <== предыдущая страница | | | следующая страница ==> |
| ХИМИЧЕСКИЙ ПОТЕНЦИАЛ.ЛЕТУЧЕСТЬ | | | УРАВНЕНИЕ ИЗОТЕРМЫ РЕАКЦИИ |
Дата добавления: 2014-03-11; просмотров: 359; Нарушение авторских прав

Мы поможем в написании ваших работ!