
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
УРАВНЕНИЕ ИЗОТЕРМЫ РЕАКЦИИ
ΔG = Σμidni = ν3 μ3 + ν4 μ4 – ν1 μ1 – ν2 μ2
ΔG = RT (ν3 μ03 + ν4 μ04 – ν1 μ01 – ν2 μ02) + RT ( ν3 lnP13 +
+ ν4 lnP14 – ν1 lnP11 – ν2 lnP12)
ΔG = RT (ν3 lnP13 + ν4 lnP14 – ν1 lnP11 – ν2 lnP12) - RTlnKp
ΔG = RT (ln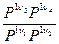 ) – lnKp - уравнение изотермы
) – lnKp - уравнение изотермы
ΔG = RT (lnK1p - lnKp)
если Рi = 1 атм
ΔG0 = - RT lnKp
Kp = e-ΔG0/RT
уравнение нормального химического сродства
Уравнение изотермы позволяет получить возможность определить
направление процесса
1. lnK1 p < lnKp ΔG < 0 реакция идет в прямом направлении
2. lnK1p > lnKp ΔG > 0 реакция идет в обратном направлении
3. lnK1p = lnKp ΔG = 0 равновесие
1.21 ЗАВИСИМОСТЬ КОНСТАНТЫ РАВНОВЕСИЯ ОТ ТЕМПЕРАТУРЫ
ΔG = Δ H + T(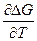 )p
)p
ΔG = RT(lnK1p - lnKp) = ΔH + T(RlnK1p - RlnKp - RT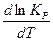 )
)
ΔH = RT2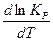
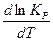 =
= 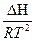 - уравнение изобары
- уравнение изобары
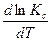 =
= 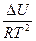 - уравнение изохоры
- уравнение изохоры
ΔH > 0 T↑ Kp↑
ΔH < 0 T↑ Kp↓
N2 + 3H2 = 2NH3 - экзотермическая реакция
Следовательно, синтез аммиака следует проводить при низких температурах.
Интегрирование уравнения дает
ln(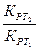 ) = -
) = - 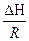 (
(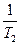 -
- 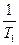 )
)
| <== предыдущая страница | | | следующая страница ==> |
| ХИМИЧЕСКОЕ РАВНОВЕСИЕ.ЗАКОН ДЕЙСТВУЮЩИХ МАСС | | | ЗАВИСИМОСТЬ КОНСТАНТЫ РАВНОВЕСИЯ ОТ ДАВЛЕНИЯ |
Дата добавления: 2014-03-11; просмотров: 396; Нарушение авторских прав

Мы поможем в написании ваших работ!