
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ХИМИЧЕСКИЙ АНАЛИЗ СТРОИТЕЛЬНЫХ МАТЕРИАЛОВ
18.1. Научно-технический прогресс преображает нашу жизнь и окружающий мир и во всем этом решающую роль играет создание и использование новых строительных материалов, изготовляемых на основе вяжущих веществ.
Вяжущими материалами называют вещества минерального и органического происхождения, применяемые для изготовления бетона и растворов, соединения строительных конструкций, гидроизоляции и др.
Сырьем для производства вяжущих материалов является природные минералы – известняк, доломит, гипс, глинистые соединения, кварцевый песо, мергели и т. п. материалы
Абсолютно преобладающим в количественном отношении вяжущим материалом, используемым в современном строительстве, является портландцемент - гидравлическое вяжущее вещество, в химическом составе которого преобладают силикаты кальция. Поэтому сырьевыми материалами для его производства являются кальцийсодержащие горные породы (известняк, мел, мрамор, известковый мергель) и кремнеземсодержащие породы (глина, глинистый сланец, глинистый мергель, опока, трепел и др.). Кроме силикатов кальция в портландцементном клинкере присутствуют в определенном количестве алюминаты и алюмоферриты кальция (до 25 %) для образования которых необходимо введение в сырьевую смесь кроме глинистых материалов еще и железосодержащих веществ (различные отходы металлургической и химической промышленности).
Строительная известь широко используется для выпуска готовых изделий гидротермального (автоклавного) твердения _ силикатного кирпича, силикатобетонных блоков, а также смешанных вяжущих.
Строительной известью называют воздушное вяжущее вещество, химически состоящее в основном из оксида кальция - СаО. Ее получают обжигом при температурах 1100-12000 С карбонатных пород (известняк, мел, доломит), состоящих преимущественно из карбоната кальция с примесями карбоната магния, глинистых и песчанистых веществ.
Разложение карбоната кальция (декарбонизация) идет по реакции:CaCO3 ⎯⎯→ CaO + CO2 с теоретическими затратами тепла 1780 кдж на 1 кг CaCO3 или 3178 кдж на 1 кг CaO.
Продукты обжига при недостаточной температуре процесса кроме CaO и MgO могут содержать неразложившийся CaCO3 и всегда в них присутствуют обожженные глинистые и песчанистые примеси. При чрезвычайно высоких температурах обжига может образоваться так называемая мертвообоженная известь, а также CaO, оплавленная золой топлива, характеризующаяся медленным взаимодействием с водой в процессе твердения известковых вяжущих.
Строительную воздушную известь в зависимости от содержания в ней MgO делят на кальциевую - (MgO не более 5 %), магнезиальную - (MgO 5-20%) и доломитовую (MgO 20-40 %).
Качество извести, как вяжущего вещества зависит, прежде всего от содержания активных CaO и MgO, методы определения которых излагаются ниже.
18.2.Задания для контрольной работы.
341.Какие три основных стадии включает технология производства цемента? Написать уравнения реакций.
342.Какими свойствами обладает железобетон, как основной конструкционный материал современного строительства. Какое свойство железобетона используют для изготовления тонкостенных куполов большого диаметра.
343.Написать формулы химических соединений характеризующих минералогический состав портландцемента. Написать химические реакции лежащие в основе схватывания цемента.
344.Что является основным сырьем промышленного производства строительных материалов. Дать характеристику и привести химические формулы соединений.
345. Основным компонентом глиноземистого цемента является алюмосиликат кальция. Написать формулу и дать характеристику этого соединения.
346.В чем отличие вяжущих воздушного и гидравлического твердения, каковы области их применения? Подтвердить формулами и уравнениями реакций.
347.Привести виды известковых вяжущих. Какие химические процессы лежат в основе приготовления строительных растворов.
348.Какова роль примесей карбоната магния в известняке при получении качественной строительной извести? Подтвердить химическими формулами и уравнениями.
349.Опишите химические процессы, определяющие затвердевание известковых вяжущих веществ.
350.Какой химический состав имеет природный и строительный гипс и в чем состоят процессы их взаимного перехода?
351.Дайте характеристику химического состава стекла и выразите процесс получения химическими уравнениями.
352.Для получения цветного стекла в исходную шихту вводят добавки. Написать формулы, и указать в какой цвет они окрашивают стекло.
353. Что является основной причиной коррозии бетонных изделий? Поясните сущность углекислотной, магнезиальной, сульфатной коррозии бетона.
354. Что представляют собой шлакопортландцемент и глиноземистый портландцемент, и каковы области их применения.
355. Объяснить, почему гидроксид натрия нельзя хранить в стеклянной посуде и с каким компонентом стекла, он взаимодействует. Подтвердить химическими формулами и уравнениями.
356. Что называют растворимым стеклом, какие компоненты его образуют и где применяется в строительстве?
357. Приведите химический состав природных силикатов и алюмосиликатов и укажите их применения в строительстве.
358. Какими свойствами обладают фототропные стекла, и что происходит с коллоидной взвесью хлоридом серебра и бромидом серебра на свету и в темноте? Написать уравнения реакций.
359. Какие коллоидные новообразования присутствуют в цементном тесте? В чем проявляется их роль в затвердевании вяжущей смеси?
360. Применение полимеров в производстве цементов. Перспективы развития технологии получения вяжущих материалов, какие факторы лежат в его основе?
ПРИЛОЖЕНИЯ.
Таблица растворимости.
| Катионы | Анионы | ||||||||||
| OH- | F- | Cl- | Br- | I- | S2- | NO3- | CO32- | SiO32- | SO42- | PO43- | |
| H+ | Р | Р | Р | Р | Р | М | Р | - | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | - | - | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | - | Н | Р | Г | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Условные обозначения:
| Р | вещество хорошо растворимо в воде | |||
| М - | малорастворимо | |||
| Н - | практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах | |||
| РК- | нерастворимо в воде и растворяется только в сильных неорганических кислотах | |||
| НК | - нерастворимо ни в воде, ни в кислотах | |||
| Г | - полностью гидролизуется при растворении и не существует в контакте с водой | |||
Константы диссоциации некоторых слабых электролитов
Кислоты
Электролит
Вода
Йодная к-та
Азотистая к-та
Ортоборная к-та
Тетраборная к-та
Бромноватая к-та
Бромноватистая к-та
Йодноватая к-та
Йодноватистая к-та
Кремниевая к-та
Марганцовистая к-та
Хлористая к-та
Хлорноватистая к-та
Молибденовая к-та
Мышьяковая к-та(орто)
Мышьяковистая (орто)
Мышьяковистая (мета)
Сернистая к-та
Сероводородная к-та
Синильная к-та
Фосфористая к-та
Фосфорная к-та (орто)
Фтороводородная к-та
Пирофосфорная к-та
Формула
H2O
HIO4
HNO2
H3BO3
H2B4O7
HBrO3
HBrO
HIO3
HIO
H2SiO3
H2MnO4
HClO2
HClO
HMoO4
H3ArO4
H3ArO3
HArO2
H2SO3
H2S
HCN
H3PO3
H3PO4
HF
H4P2O7
Величина константы диссоциации
К=1,8*10-16
К=2,45*10-2
К=501*10-4
К1=701*10-10
К2=1,8*10-13
К3=1,6*10-14
К1=1,8*10-4
К2=2,0*10-8
К=2,0*10-1
К=2,2*10-9
К=1,7*10-1
К=1,3*10-11
К1=2,2*10-10
К2=1,6*10-12
К1=1,0*10-1
К2=7,1*10-11
К=1,1*10-2
К=2,95*10-8
К1=5,6*10-3
К2=1,4*10-4
К1=5,6*10-3
К2=1,7*10-7
К3=5,6*10-3
К1=6,0*10-10
К2=2,95*10-12
К=6,0*10-10
К1=1,4*10-2
К2=6,2*10-8
К1=1,0*10-7
К2=2,5*10-13
К=5,0*10-10
К1=3,1*10-2
К2=1,6*10-7
К1=3,1*10-3
К2=6,2*10-8
К3=5,0*10-23
К=6,6*10-10
К1=1,2*10-1
К2=7,9*10-3
К3=2,0*10-7
К4=408*10-1
Основания
| Электролит | Формула | Величина константы диссоциации |
| Гидроксид аллюминия | Al(OH)3 | К1=10-9 К2═10-18 К3═10-27 |
| Гидроксид аммония | NH4OH | К═1,79*10-5 |
| Гидроксид кобальта (II) | Co(OH)2 | К1═10-4 К2═10-9 |
| Гидроксид серебра | AgOH | К═1,1*10-4 |
| Гидроксид железа (III) | Fe(OH)3 | К1═10-11 К2═10-22 К3═10-30 |
| Гидроксид железа (II) | Fe(OH)2 | К1═10-5 К2═10-22 |
| Гидроксид хрома (III) | Cr(OH)3 | К1═10-10 К2═10-18 К3═10-24 |
| Гидроксид меди (II) | Cu(OH)2 | К1═10-6 К2═10-14 |
| Гидроксид ртути (II) | Hg(OH)2 | К1═10-10 К2═10-21 |
| Гидроксид марганца (II) | Mn(OH)2 | К1═10-3 К2═10-5 |
| Гидроксид никеля (II) | Ni(OH)2 | К1═10-4 К2═10-5 |
| Гидроксид цинка | Zn(OH)2 | К1═10 К2═10-11 |
Произведение растворимости (ПР) некоторых малорастворимых в воде соединений
| Вещество | ПР | Вещество | ПР |
| MgF2 | 7.1*10-9 | PbSO4 | 1.6*10-8 |
| CaF2 | 3.4*10-11 | Ca3(PО4)2 | 1.0*10-25 |
| BaF2 | 1.7*10-6 | Mg(OH)2 | 1.2*10-11 |
| AgCl | 1.6*10-10 | Ca(OH)2 | 5.5*10-6 |
| AgBr | 4.0* 10-13 | Cd(OH)2 | 6.0* 10-15 |
| AgI | 9.7* 10-17 | Cr(OH)3 | 5.4* 10-31 |
| PbI2 | 8.1*10-9 | Fe(OH)2 | 1.7*10-15 |
| MgCO3 | 2.0* 10-4 | Fe(OH)3 | 1.1*10-36 |
| CaCO3 | 1.2*10-8 | A1(OH)3 | 5.1*10-33 |
| ВаСО3 | 8.1*10-9 | CuS | 3.2*10-38 |
| Ag2CrO4 | 4.1*10-12 | Ag2S | 5.7*1051 |
| CaCrO4 | 2.3* 10-2 | CdS | 1.2*10-28 |
| BaCrO4 | 1.6*10-10 | HgS | 4.0* 10-53 |
| PbCrO4 | 1.8*10-14 | PbS | 3.6*10-29 |
| CaSO4 | 6.1*10-5 | MnS | 7.0* 10-16 |
| SrSO4 | 2.8*10-7 | FeS | 3.7*10-19 |
| BaSO4 | 1.1*10-10 | ZnS | 8*10-26 |
| Стандартные электродные потенциалы при 25°С | |||
| Электродный процесс | Потен-циал, В | Электродный процесс | Потен-циал, В |
| Li = Li++le– | -3,045 | Ag=Ag++e– | 0,799 |
| Rb = Rb++le– | -2,925 | Hg=2Hg2++2 e– | 0,850 |
| K = K++le– | -2,924 | Hg2+2=2Hg2++2e– | 0,920 |
| Cs = Cs++le– | -2,923 | I–+Н2О=НIO+Н++2e– | 0,990 |
| Са = Са2++2е– | -2,866 | Со(ОН)2+ОН–=Со(ОН)3+ е– | 1,0 |
| Na = Na++le– | -2,714 | 2Вr–=Вг2(ж.)+2 е– | 1,065 |
| Mg = Mg2++2e– | -2,363 | I–+6ОН–=IO–3+ЗН2О+6е– | 1,09 |
| 2H– = H2+2e– | -2,251 | H2SeO3+H2O=SeO2–4+4H++2 e– | 1,15 |
| Al = Al3++3e– | -1,663 | Ni(OH)2+OH–=Ni(OH)3+ e– | 1,22 |
| A1+4OH– = A1О2– +2H2О+3e– | -1,262 | 2Н2O=О2+4Н++4 е– | 1,228 |
| Mn = Mn2++2e– | -1,179 | I–+2ОН–=IO–+Н2О+2 e– | 1,32 |
| Cr = Cr2++2e– | -0,913 | Вr–+Н2О=НВrO+Н++2 е– | 1,33 |
| Zn=Zn2++2e– | -0,763 | 2С13++7Н2О=Сr2О72–+ 14Н++6е– | 1,333 |
| Cr=Cr3++3e– | -0,744 | 2Сl–=С12(газ)+2 е– | 1,359 |
| Fe=Fe2++2e– | -0,440 | Вr–+6ОН–=ВrО3–+ЗН2О+6 е– | 1,44 |
| Cd=Cd2++2e– | -0,403 | РЬ2++2Н2О=РbО2+4Н++2 е– | 1,449 |
| Co=Co2++2 e– | -0,277 | Сl–+6ОН–=СlO3–+ЗН2О+6 е– | 1,451 |
| Ni=Ni2++2 e– | -0,250 | Сl–+Н2О=НС1О+Н++2 е– | 1,494 |
| Sn=Sn2++2e– | -0,136 | Мn2++4Н2О=МnО4–+8Н++5 е– | 1,507 |
| Pb=Pb2++2e– | -0,126 | Вr–+2ОН–=ВrO–+Н2О+2 е– | 1,59 |
| Fe=Fe3++3 e– | -0,037 | PbSO4+2H2O=PbO2+SO42–+4Н++2 е– | 1,685 |
| H2=2H++2 e– | 0,0 | Au=Au++ e– | 1,692 |
| Bi=Bi3++3 e– | 0,215 | МnО2+2Н2О=МnО4–+4Н++Зе– | 1,692 |
| Cu=Cu2++2e– | 0,337 | Рb2+=Рb4++2 е– | 1,694 |
| Cu=Cu++e– | 0,520 | Сl–+2ОН–=С1О–+Н2О+2 e– | 1,77 |
| 2I–=I2(тв.)+2е– | 0,530 | 2Н2О=Н2О2+2Н++2 е– | 1,776 |
| MnO42–=MnO4–+e– | 0,564 | Со2+=Со3++e– | 1,808 |
| H2O2=O2+2H++2e– | 0,682 | 2SO42–=S2O82–+2 e– | 2,010 |
| Fe2+=Fe3++ e– | 0,771 | 4ОН–=О2+2Н2О+4 е– | 2,054 |
| 2Hg=Hg22++2e– | 0,789 | 2F–=F2+2 e– | 2,87 |
Номенклатура солей
| Формула | Название кислоты | Номенклатура солей | ||
| Русская | Международная | |||
| H2ZnO2 | Цинковая | Цинковокислые | Цинкаты | |
| Н2В4О7 | Тетраборная | Тетраборнокислые | Тетрабораты | |
| НВО2 | Метаборная | Метаборнокислые | Метабораты | |
| Н3ВО3 | Ортоборная | Ортоборнокислые | Ортобораты | |
| НАlO3 | Метаалюминиевая | Метаалюминиевакислые | Метаалюминаты | |
| HNO2 | Азотистая | Азотокислые | Нитриты | |
| HNO3 | Азотная | Азотнокаслые | Нитраты | |
| Н3РО2 | Фрсфорноватистая | Фрсфорноватистокислые | Гипофосфиты | |
| Н3РO3 | Фосфористая | Фосфористокислые | Фосфиты | |
| НРO3 | Метафосфорная | Метафосфорнокислые | Метафосфаты | |
| Н4Р207 | Пирофосфорная | Пирофосфорнокислые | Пирофосфаты | |
| Н3Р04 | Ортофосфорная | Ортофосфорнокислые | Ортофосфаты | |
| HAsO2 | Метамышьяко-вистая | Метамышьяковисто-кислые | Метаарсениты | |
| H3AsO3 | Ортомышьяко-вистая | Ортомышьяковисто-кислые | Ортоарсениты | |
| HAsO3 | Метамышьяковая | Метамышьяковокислые | Метаарсенаты | |
| H4As2O7 | Пиромышьяковая | Пиромышьяковокислые | Пироарсенаты | |
| H3AsO4 | Ортомышьяковая | Ортомышьяковокис-лые | Ортоарсенаты | |
| HSbO3 | Метасурьмяная | Метасурьмянокислые | Метаантимонаты | |
| H4Sb2O7 | Пиросурьмяная | Пиросурьмянокислые | Пироантимонаты | |
| H3SbO4 | Ортосурьмяная | Ортосурьмянокислые | Ортоантимонаты | |
| H2S | Сероводородна | Сернистые | Сульфиды | |
| H2SO3 | Сернистая | Сернистокислые | Сульфиты | |
| H2S2O3 | Тиосерная (серноватистая) | Тиосернокислые (серноватистокислые) | Тиоосульфаты | |
| H2S2O7 | Пиросерная | Пиросернокислые | Пиросульфаты | |
| H2SO4 | Серная | Сернокислые | Сульфаты | |
| HCrO2 | Метахромистая | Метахромистокислые | Метахромиты | |
| Н3СгО3 | Ортохромистая | Ортохромистокислые | Ортохромиты | |
| Н2Сг2O7 | Двухромовая | Двухромовокислые | Бихроматы | |
| Н2СrO4 | Хромовая | Хромовокислые | Хроматы | |
| Н2МnО4 | Марганцовистая | Марганцовистокислые | Манганаты | |
| НМnО4 | Марганцовая | Марганцовокислые | Перманганаты | |
| НС1 | Хлористоводородная (соляная) | Хлористые | Хлориды | |
| НС1O | Хлорноватистая | Хлорноватистокислые | Гипохлориты | |
| НСlO2 | Хлористая | Хлористокислые | Хлориты | |
| НСlO3 | Хлорноватая | Хлорноватокислые | Хлораты | |
| НСlO4 | Хлорная | Хлорнокислые | Перхлораты | |
| НВr | Бромистоводо-родная | Бромистые | Бромиды | |
| НВrO | Бромноватистая | Бромноватистокислые | Гипобромиты | |
| НВrO3 | Бромноватая | Бромноватокислые | Броматы | |
| HI | Иодистоводо-родная | Йодистые | Иодиды | |
| HIO | Иодноватистая | Иодноватистокислые | Гипойодиты | |
| HIO3 | Йодноватая | Иодноватокислые | Иодаты | |
| HIO4 | Йодная | Иоднокислые | Перйодаты | |
| HCN | Цианистоводородная (синильная) | Цианистые | Цианиды | |
| HCNO | Циановые | Циановокислые | Цианаты | |
| HNCS | Роданистоводо-родная | Роданистые | Роданиды (тио-цианиды) | |
| Н2СО3 | Угольная | Углекислые | Карбонаты | |
| НСООН | Муравьиная | Муравьинокислые | Формиаты | |
| СН3СООН | Уксусная | Уксуснокислые | Ацетаты | |
| Н2С2О4 | Щавелевая | Щавелевокислые | Оксалаты | |
| H2SiO3 | Кремневая | Кремнекислые | Силикаты |
Стандартные энтальпии образования
некоторых соединений.
| CO(г) | - 110,5 | |
| CO2(г) | - 393,51 | |
| NaCl(к) | - 410,9 | |
| Ca(OH)2(к) | - 986,2 | |
| CaCO3(к) | - 1206,0 | |
| C6H6(ж) | - 49,04 | |
| N2O4(г) | - 9,37 | |
| NH3(г) | - 46,19 | |
| ZnO(к) | - 349,0 | |
| CaO | - 260 | |
| HqO | - 91 | |
| CuSO4(к) | - 771,1 | |
| NO2(г) | - 33,89 | |
| Al2O3 | - 1675,0 | |
| CaO | - 635 | |
| FeS2 | - 177 | |
| C2H5OH(ж) | - 484,9 | |
| C2H4(г) | 52,28 | |
| CS2(г) | 115,3 | |
| CS2(ж) | 87,8 | |
| CH4(г) | - 74,85 | |
| H2O(г) | - 241,84 | |
| H2O(ж) | - 285,84 | |
| CH3OH(ж) | - 238,7 | |
| C2H2(г) | - 226,75 | |
| HCl(ж) | - 167,5 | |
| CH3COOH(ж) | - 484,9 | |
| MgO | - 601,24 | |
| CuO(к) | - 165,3 | |
| SO2(г) | - 296,3 |
Таблица пересчета рН на концентрацию водородных ионов
[Н+] и наоборот
| Десятые доли рН | Сотые доли рН | ||||||||||||
| ,00 | ,01 | ,02 | ,03 | ,04 | ,05 | ,06 | ,07 | ,08 | ,09 | ||||
| ,0 | 1,000 | 0,977 | 0,955 | 0,933 | 0,912 | 0,891 | 0,871 | 0,851 | 0,832 | 0,813 | |||
| 0,794 | 0,766 | 0,759 | 0,741 | 0,725 | 0,708 | 0,692 | 0,676 | 0,661 | 0,646 | ||||
| ,2 | 0,631 | 0,617 | 0,603 | 0,589 | 0,575 | 0,562 | 0,550 | 0,538 | 0,525 | 0,513 | |||
| ,3 | 0,501 | 0,490 | 0,479 | 0,468 | 0,457 | 0,447 | 0,437 | 0,427 | 0,417 | 0,407 | |||
| ,4 | 0,398 | 0,389 | 0,380 | 0,372 | 0,363 | 0,355 | 0,347 | 0,339 | 0,331 | 0,324 | |||
| ,5 | 0,316 | 0,309 | 0,302 | 0,295 | 0,288 | 0,282 | 0,275 | 0,269 | 0,263 | 0,257 | |||
| ,6 | 0,251 | 0,245 | 0,240 | 0,234 | 0,229 | 0,224 | 0,219 | 0,214 | 0,209 | 0,204 | |||
| ,7 | 0,200 | 0,195 | 0,191 | 0,186 | 0,182 | 0,178 | 0,174 | 0,170 | 0,166 | 0,162 | |||
| ,8 | 0,158 | 0,155 | 0,151 | 0,148 | 0,145 | 0,141 | 0,138 | 0,135 | 0,132 | 0,129 | |||
| ,9 | 0,126 | 0,123 | 0,120 | 0,117 | 0,115 | 0,112 | 0,110 | 0,107 | 0,105 | 0,102 | |||
Примечания.
а) Для определения [Н+] по известному рН находят в первом вертикальном столбце первый знак мантиссы величины рН и в первой горизонтальной строке -второй знак этой мантиссы. В точке пересечения линий, идущих от найденных цифр, находят значение [Н+], умножают его на 10 в степени, равной характеристике рН, но взятой с отрицательным знаком.
Пример: рН = 5,36. Тогда [Н+] = 0,437- 10 -5.
6) Для определения рН по известной величине [Н+] преобразуют величину [Н+] так, чтобы она имела вид числа, начинающегося с 0 и умноженного на 10 в некоторой отрицательной степени. Это число находят в середине таблицы. Зачтем, двигаясь от него влево и вверх, находят два знака после запятой в величине рН. Характеристика рН будет равна той степени, в которую возведено число 10 в величине [Н+], но с положительным знаком.
Пример: [Н+] = 2,34 10 -7 = 0,234*10 -6. Тогда рН = 6,63.
Классификация органических соединений
по функциональным группам
| Функциональная группа | Класс | Формула |
| Углеводороды | ||
| - | Алканы | 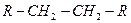
|
| = | Алкены | 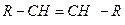
|
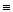
| Алкины | 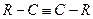
|
| (=, =) | Алкадиены | 
|
| Циклоалканы | 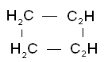
| |
| Арены | 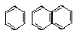
| |
| Производные углеводородов | ||
| -Г(-Cl,-Br,-I,-F) галоген | Галагеноземещенные | 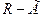
|
| -NO2 нитро- | Нитросоединения | 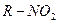
|
| -SO3 Н сульфо- | Сульфокислоты | 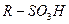
|
| -OH гидрокси- | Спирты | 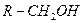
|
| Фенолы | 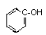
| |
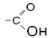
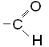 карбонил
карбонил
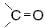
| Альдегиды | 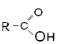
|
| Кетоны | 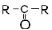
| |
 карбоксил
карбоксил
| Карбоновые кислоты | 
|
| Производные карбоновых кислот | ||
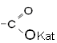
| Соли | 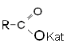
|
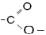
| Сложные эфиры | 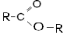
|
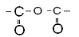
| Ангидриды | 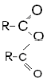
|

| Галоген-андигриды | 
|
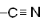
| Нитрилы | 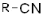
|
| Производны аммиака (NH3 ) | ||
 амино
амино
| Первичные амины | 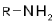
|
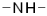
| Вторичные амины | 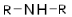
|
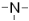
| Третичные амины | 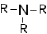
|
| Производные спиртов, фенолов | ||
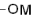 (металл) (металл)
| Алкоголяты | 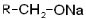
|
| Феноляты | 
| |
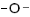
| Простые эфиры | 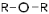
|
Названия предельных углеводородов
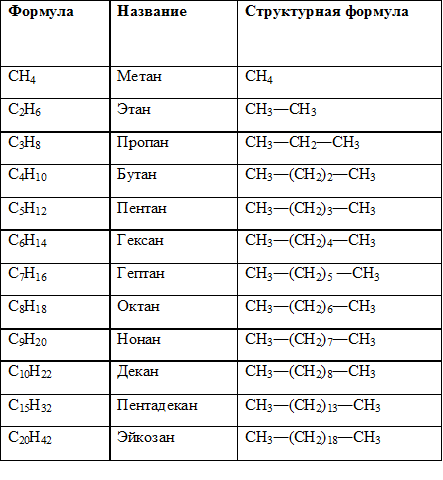
 |
7.5.Варианты заданий для выполнения контрольной работ
Содержание.
| Основные правила работы и техника безопасности в химической лаборатории. | |
| Общие методические рекомендации по изучению дисциплины | |
| Химическая символика классификация неорганических соединений | |
| Основные законы общей химии. Стехиометрия. | |
| Химический эквивалент. | |
| Строение атома. Периодический закон и периодическая таблица Д.И. Менделеева. | |
| Термодинамика и термохимия | |
| Химическая кинетика и химическое равновесие. | |
| Коллоидные растворы. | |
| Растворы | |
| Электролитическая диссоциация. Водородный показатель. | |
| Ионно-молекулярные уравнения реакций обмена | |
| Гидролиз солей. | |
| Окислительно-восстановительные реакции. | |
| Электродные потенциалы и электродвижущие силы | |
| Электролиз | |
| Общие свойства металлов. | |
| Основы органической химии. Полимеры. | |
| Химический анализ строительных материалов | |
| Приложения | |
| Варианты заданий для выполнения контрольной работ |
7.5.Варианты заданий для выполнения контрольной работ
| Последние цифры номера зачетной книжки | Номера заданий | ||||||||||||||||||||
Дата добавления: 2014-09-08; просмотров: 1407; Нарушение авторских прав 
Мы поможем в написании ваших работ! |