
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ИЗМЕНЕНИЕ ЭНТРОПИИ В РАЗЛИЧНЫХ ПРОЦЕССАХ
Для расчета изменения энтропии при равновесных процессах используется соотношение
dS = 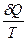
1.Изменение энтропии при фазовых превращениях
Фазовые превращения происходит при постоянной температуре
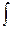 dS =
dS = 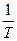
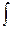 dQР
dQР
DS = S2 – S1 = 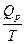 =
= 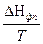 ,
,
где DНФП - теплота фазового перехода, Т - температура фазового перехода. Энтропия при фазовых превращениях изменяется скачком.
2.Изменение энтропии при изотермическом расширении (сжатии) моля газа
DS = 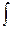
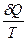 =
= 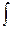 Rdln
Rdln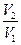
dQ = RT dln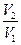
DS = R ln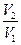
3.Изменение энтропии при нагревании системы
dS = 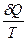 = CР
= CР 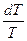
DS = 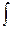 CР
CР 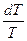 =
= 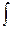 CР dlnT
CР dlnT
DS = CР ln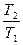
CР = a + bT + c T2
DS = aln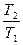 + b(T2 – T1) +
+ b(T2 – T1) + 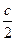 (T22 – T12)
(T22 – T12)
4.Изменение энтропии идеального газа
dQ = dU + dW
dQ = nCV dT + PdV
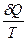 = dS = nCV
= dS = nCV 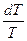 +
+ 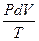 = P/T = nR/V
= P/T = nR/V
= nCV dlnT + nRdlnV = nCP dlnT - nRdlnP
DS = nCV ln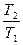 + nRln
+ nRln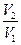 = nCP ln
= nCP ln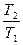 – nRln
– nRln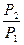
а) изотермический процесс
DS = nRln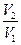 = nRln
= nRln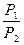
б) изохорический процесс
DS = nCV ln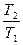
в) изобарный процесс
DS = nCP ln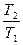
| <== предыдущая страница | | | следующая страница ==> |
| НЕОБРАТИМЫХ ПРОЦЕССОВ | | | ПОСТУЛАТ ПЛАНКА.ВЫЧИСЛЕНИЕ АБСОЛЮТНОЙ ЭНТРОПИИ |
Дата добавления: 2014-03-11; просмотров: 477; Нарушение авторских прав

Мы поможем в написании ваших работ!