
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ВИД АТОМНЫХ ОРБИТАЛЕЙ
Важные для химика-экспериментатора сведения можно получить, рассмотрев вид различных орбиталей являющихся приемлемыми решениями уравнения Шрёдингера. Напомним, что, согласно требованиям принципа неопределенности, мы можем судить о нахождении электрона на различных орбиталях (s, p, d, f) в определенных положениях только в терминах вероятностей y2.
Рассмотрим подробно s-орбитали. Уравнения для Is-, 2s- и 3s-орбиталей и аналогичные выражения для других s-орбиталей показывают, что амплитуда y не зависит от углов q и j>, которые не появляются в формулах для этих орбиталей.
Поскольку ydt не зависит от углов, s-орбитали должны обладать сферической симметрией относительно ядра. котором изображена. Такая поверхность дает представление о виде s-орбитали и является графиком зависимости r от q и j в сферических координатах
S - орбитали
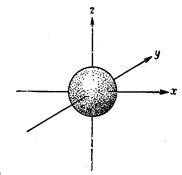
р- орбитали
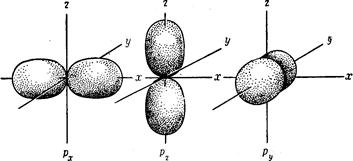
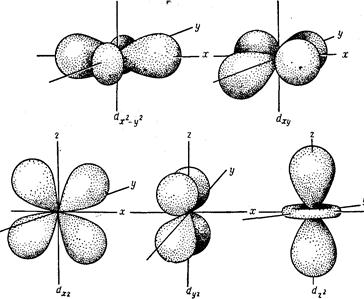
d - орбитали
. р-Орбитали являются трехмерными поверхностями, которые можно представить себе, рассматривая поверхности, возникающие при вращенииих двумерных изображений на 180° вокруг осей.
d-Орбитали также являются трехмерными поверхностями; орбиталь dx-y располагается вдоль осей х и у, орбиталь dxy—между осями х и у, dyz—между у и z, dxz—между х и z, a dz— вдоль оси z.
| <== предыдущая страница | | | следующая страница ==> |
| КВАНТОВЫЕ ЧИСЛА | | | ДРУГИЕ АТОМЫ |
Дата добавления: 2014-03-11; просмотров: 759; Нарушение авторских прав

Мы поможем в написании ваших работ!