
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Равновесие при адсорбции
Равновесная концентрация 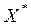 (
(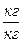 чистого адсорбента) поглощаемого вещества в адсорбенте может быть представлена:
чистого адсорбента) поглощаемого вещества в адсорбенте может быть представлена:
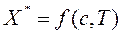 , (6.1)
, (6.1)
Или, в случае адсорбции газов:
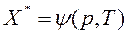 , (6.2)
, (6.2)
Здесь с – концентрация адсорбтива в объемной сплошной фазе, р– парциальное давление адсорбтива в объемной фазе. Зависимость 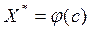 или
или 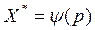 при T=const называется изотермой адсорбции.
при T=const называется изотермой адсорбции.
Равновесные зависимости описываются рядом эмпирических и теоретических уравнений. Одна из них уравнение Лангмюра:
 (6.4)
(6.4)
Здесь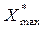 - предельная величина адсорбции, при полном заполнение внутренних пор мономолекулярным слоем адсорбата, b- константа, зависящая от температуры (рис.6.1)
- предельная величина адсорбции, при полном заполнение внутренних пор мономолекулярным слоем адсорбата, b- константа, зависящая от температуры (рис.6.1)
Изотермы адсорбции обычно определяются опытным путем.

Рис.6.1. Изотермы адсорбции: 1 – изотерма Лангмюра, 2,3,4 – реальные изотермы
(2 – линейная, 3 – вогнутая, 4 – выпуклая).
Адсорбция сопровождается уменьшением парциального давления поглощаемого компонента из газовой смеси и заметным выделением тепла. Поэтому количество адсорбированного вещества возрастает с понижением температуры и повышением давления (рис.6.2).
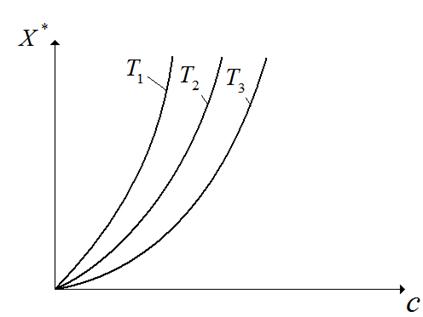
Рис.6.2. Изотермы адсорбции для одного вещества при различных температурах: 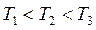 .
.
| <== предыдущая страница | | | следующая страница ==> |
| Адсорбенты | | | Материальный баланс адсорбции |
Дата добавления: 2014-03-22; просмотров: 230; Нарушение авторских прав

Мы поможем в написании ваших работ!