
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Напишите структурную формулу коричной (3-фенилпропеновой) кислоты
4. Лейцин, входящий в состав белков, имеет строение CН3СН(СН3)CH2СН(NН2)СООН. Укажите его название по заместительной (международной) номенклатуре:
а) 2-метил-4-аминопентановая кислота, б) 4-амино-2- метилпентановая кислота, в) 2-амино-4-метилпентановая кислота, г) a-амино-g-метилвалериановая кислота.
Тема 2. Химическая связь и взаимовлияние атомов
в органических соединениях.
Электронное строение атома углерода. Гибридизация.
Для валентного электронного слоя атома С, находящегося вглавной подгруппе четвёртой группы второго периода Периодической таблицы Д. И. Менделеева главное квантовое число n = 2, побочное (орбитальное) квантовое число l = 0 (s-орбиталь) и 1 (р-орбиталь); магнитное квантовое число m = 0 (при l = 0) и –1, 0, 1 (при l = 1).
Для того, чтобы привести в соответствие электронную формулу атома С и его валентность, допускают возбуждение внешнего электронного слоя атома углерода. Тогда в атоме С 1s-орбиталь и 3р-орбитали. При перекрывании атомных орбиталей (АО) атомов С и Н три связи С–Н будут одинаковыми, а 4-я должна отличаться по прочности (связь по s- орбитали должна быть менее прочной из-за меньшего перекрывания орбиталей). В действительности это не так. Несоответствие исключается предположением о гибридизации различающихся по форме и энергии АО с появлением гибридных АО. В результате валентные электроны оказываются не на чистых s- и р- орбиталях, а на одинаковых гибридных. Для алканов характерна sр3- гибридизация (участвуют все 4 АО внешнего электронного уровня). В непредельных соединениях одна или две негибридизованные р-орбитали участвуют в образовании p-связей, при этом тип гибридизации атома углерода – sр2 для алкенов и sр для алкинов.
Гибридные орбитали алканов располагаются в пространстве симметрично и направлены к вершинам тетраэдра. Связь С–Н образуется перекрыванием s-орбитали атома Н и гибридизованной орбитали атома С, связь С–С образуется за счет перекрывания 2-х гибридизованных орбиталей (направление связи – по оси между атомами). Это s- связь.
Свойства s-связи:
- относительная химическая инертность вследствие высокой прочности;
- максимум электронной плотности расположен симметрично относительно оси, соединяющей атомы, поэтому возможно свободное вращение вдоль этой оси без изменения перекрывания орбиталей (конформеры);
- длина связи 0,154 нм; угол между направлениями орбиталей 109,5°;
- электроотрицательность атома С в sр3-гибридном состоянии = 2,51;
Атом углерода, связанный двойной связью с другим атомом углерода, находится в состоянии sр2-гибридизации. (участвуют 3 АО внешнего электронного уровня). Гибридные орбитали располагаются в пространстве симметрично в одной плоскости, содержащей ядра С. Оставшаяся негибридизированная р-АО ориентирована перпендикулярно этой плоскости. Связь С–Н образуется перекрыванием s-орбитали атома Н и гибридизованной орбитали атома С. Связь С–С образуется за счет перекрывания 2-х гибридизованных орбиталей (направление – по оси между атомами, в плоскости молекулы). Это s-связь. Две негибридизованные р-АО перекрываются выше и ниже плоскости молекулы – образуется p-связь.
Отличие двойной связи от одинарной:
- расстояние между атомами углерода при двойной связи меньше, чем при одинарной (0,134 нм); угол между гибридными АО 120°;
- электроотрицательность гибридизованного атома С = 2,69;
- затрудненное вращение вокруг линии, соединяющей атомы С;
- двойная связь более прочна, т.к. увеличивается электронная плотность на связывающих МО между атомами углерода (термическая стойкость этилена выше, чем этана);
- высокая реакционная способность p-связи, что объясняется большей подвижностью электронов вне плоскости молекулы;
- повышенная электронная плотность по сравнению с одинарной связью, причем на периферии молекулы. Это приводит к тому, что к двойной связи притягиваются положительно заряженные ионы или полярные молекулы своим положительным полюсом.
Связи С–Н в ацетилене относятся к числу s-связей, образованных путем перекрывания s-орбитали водорода с гибридизованной sp-орбиталью углерода; в молекуле имеется одна углерод-углеродная s-связь (образованная перекрыванием двух гибридизованных sp-орбиталей углерода) и две углерод-углеродные p-связи (результат перекрывания двух взаимно перпендикулярных пар негибридизованных р-орбиталей (ру и рz)атомов углерода).
Свойства тройной связи:
- атомы углерода, связанные тройной связью, имеют электроотрицательность = 2,75;
- длина СºС-связи = 0,120 нм;
- валентные углы в ацетилене на основании этой модели равны 180° и молекула имеет линейную конфигурацию, что делает невозможной цис-транс-изомерию при тройной связи;
- связь сильно поляризована, т.к. в sр- гибридной форме углеродный атом сильнее удерживает электроны, чем в sр2 и sр3 – гибридных формах; следовательно; электронная пара СН-связи в молекуле ацетилена ближе к ядру С, чем в случае этилена, атом Н более подвижен, обладает слабыми кислотными свойствами (в отличие от алканов и алкенов).
Сопряженные системы
Различают два типа сопряженных систем (и сопряжений).
 1. p, p-сопряжение — электроны делокализованы между двумя (и более) кратными связями. Например, в делокализации электронов в молекуле бутадиена участвуют четыре атома углерода: СН2=СН–СН=СН2 « СН2–¾СН–¾СН–¾СН2
1. p, p-сопряжение — электроны делокализованы между двумя (и более) кратными связями. Например, в делокализации электронов в молекуле бутадиена участвуют четыре атома углерода: СН2=СН–СН=СН2 « СН2–¾СН–¾СН–¾СН2
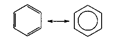 В молекуле бензола делокализация происходит с участием 6 атомов углерода (три двойные связи, каждую образует 2 электрона, по одному от каждого атома):
В молекуле бензола делокализация происходит с участием 6 атомов углерода (три двойные связи, каждую образует 2 электрона, по одному от каждого атома):
Кроме того, при осуществлении «кругового» сопряжения, как в бензоле, система получает дополнительный существенный выигрыш энергии, называемый энергией сопряжения. Например, энергия сопряжения молекулы бензола равна 15 кДж/моль.
2. р, p-сопряжение — в делокализации принимают участие электроны p-связи и р-орбитали гетероатома; например, в молекулах ацетамида и пиррола:
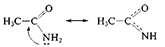 | 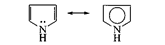 | ||
В случае молекулы ацетамида в делокализации участвуют три атома (С, О, N); в случае молекулы пиррола — пять атомов (4 атома С и атом N). Чем длиннее система сопряжения, тем более она устойчива. Ароматическая система представляет собой устойчивую плоскую циклическую сопряженную полиеновую структуру, содержащую (4п + 2) p-электронов (п = 1, 2, 3, ...). Например, бензол – ароматическая структура (6 p-электронов), а 1,3,5,7-циклооктатетраен – нет (8 p-электронов).
Делокализация электронов является одним из важных факторов повышения устойчивости молекул и ионов, поэтому это явление широко распространено в биологически важных молекулах (витамины, гем, хлорофилл, гемоглобин и др.).
Витамин А относится к сесквитерпенам (терпены – 10 углеродов и 3 дв. связи), содержится в масле, молоке, яичном желтке, рыбьем жире; свиное сало и маргарин его не содержат. Это витамин роста; недостаток его в пище вызывает убыль в весе, высыхание роговицы глаз, понижение сопротивляемости к инфекции. Витамин А заменяют каротином (тритерпен) С40Н56, (пигмент моркови); в организме человека каротин превращается в витамин А.

 Н3С
Н3С




 Н3С СН3 СН3 СН3
Н3С СН3 СН3 СН3

 СН=СН–С=СН–СН=СН–С=СН–СН=СН–СН=С–СН=СН–СН=С–СН=СН–
СН=СН–С=СН–СН=СН–С=СН–СН=СН–СН=С–СН=СН–СН=С–СН=СН–
СН3 СН3
СН3 b-каротин Н3С СН3


 Н3С СН3 СН3 СН3
Н3С СН3 СН3 СН3
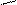 СН=СН–С=СН–СН=СН–С=СН–СН2 – ОН
СН=СН–С=СН–СН=СН–С=СН–СН2 – ОН
СН3 витамин А
В молекуле хлорофилла также присутствует развитая система сопряжённых связей – 4 остатка пиррола, образующих вместе порфириновое ядро, связанное с атомом магния. Хлорофилл — сложный эфир двухосновной кислоты и спиртов — метанола и фитола С20Н39ОН. По строению он близок к дыхательным ферментам (каталазе, пероксидазе) и к красящему веществу крови — гему.
Типы атомов углерода. Атомы, соединенные с одним углеродным атомом называются первичными, соответственно называются первичными и три атома водорода у первичного углеродного атома. Атом углерода, соединенный с двумя атомами углерода называется вторичным, а два атома водорода у него называются вторичными атомами водорода. Атом, соединенный с тремя другими атомами С, называется третичным, каки единственный атом водорода при нем; а атом углерода, связанный с четырьмя атомами С – четвертичным.
Электронные эффекты (индуктивный и мезомерный)
Поляризация молекулы обусловлена различным влиянием атомов, входящих в состав молекулы. Атомы с большой электроотрицательностью притягивают к себе электроны s-связей. Такой вид поляризации (сдвиг электронной плотности s-связи под действием разности в электроотрицательности связанных атомов) называется индуктивным эффектом (обозначается заглавной латинской буквой I и прямой стрелкой (®)). Если в связи С-Х электронная плотность сдвинута в сторону заместителя Х по сравнению со связью С-Н, то такое влияние заместителя называют отрицательным индуктивным эффектом (-I). Если же смещение происходит в сторону атома С по сравнению со связью С-Н, то такое действие заместителя называют положительным индуктивным эффектом (+I). При передаче по цепи индуктивный эффект затухает.

 Н Н
Н Н

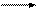
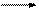 Н Сd+2 Сd+1 Сld- d+2 < d+1
Н Сd+2 Сd+1 Сld- d+2 < d+1
Н Н
+I- Эффектом характеризуются алкильные радикалы, -I эффектом– атомы галогенов, функциональные группы, содержащие кислород, азот, серу, кратные связи, а также группы, несущие положительный заряд.
Если в молекуле имеются системы сопряженных простых и кратных связей или атомы с неподеленными электронными парами, включенными в систему сопряжения, они могут участвовать в образовании общего p-электронного облака. Участие групп в сопряжении и влияние их на состояние p-электронного облака молекулы называют мезомерным эффектом (сдвиг электронной плотности сопряжённых p-связей) , или эффектом сопряжения (обычно обозначается заглавной буквой М; реже – заглавной буквой С). Для его обозначения используется изогнутая стрелка. У атомов азота, кислорода, фтора внешняя электронная оболочка заполнена, и они способны смещать p-электроны неподеленной электронной пары в сторону бензольного ядра или ненасыщенного углеродного атома:
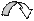 | |||
 |
СН3 - О - СН = Сd-Н2
Если в систему сопряжения входит кратная связь между разнородными атомами, то общее p-электронное облако смещается в сторону более электроотрицательного атома:
 Od-
Od-
СН2 = СН-Cd+
Н
Положительный мезомерный эффект проявляют группы: –ОН; –OR; –NH2; -NR2; –SH; галогены (смещение электронной плотности от гетероатома); отрицательный: группы -NO2, -CºN, -СООН, -SО3Н (смещение электронной плотности к гетероатому функциональной группы). Наличие индуктивного и мезомерного эффектов приводит к перераспределению электронной плотности в молекуле. В результате на одних атомах концентрируется частичный отрицательный, а на других – частичный положительный заряды. В свою очередь, это перераспределение зарядов определяет реакционную способность соединений, их кислотно-основные свойства, дипольный момент молекул, силу межмолекулярных связей (а значит и такие свойства как темперутуры кипения и плавления, растворимость).
Контрольные задания
1. Выберите углеводород, в молекулах которого орбитали всех атомов углерода находятся в состоянии sр3- гибридизации:
а) пропен; б) 1-бром-2-бутен; в) 2,2-диметилпропан; г) пропин.
| <== предыдущая страница | | | следующая страница ==> |
| Составить полное название соединения | | | Напишите структурную формулу ментола (2-изопропил-5-метил-циклогексанол). Определите тип гибридизации каждого атома углерода в ментоле |
Дата добавления: 2014-04-05; просмотров: 673; Нарушение авторских прав

Мы поможем в написании ваших работ!