
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Напишите уравнения бромирования, сульфирования, и нитрования бутана
3. По какому механизму идёт реакция нитрования алканов:
а) радикального замещения; б) нуклеофильного присоединения; в) радикального присоединения;
в) электрофильного присоединения; г) электрофильного замещения?
4. Напишите уравнения реакции присоединения бромоводорода к 1-бутену в присутствии перекиси и без нее. В виде каких стереоизомеров может существовать исходное соединение? Образуют ли стереоизомеры продукты реакции?
5. Какое соединение образуется при гидратации 1-бутена:
а) 1-бутанол; б) 1-бутин; в) 2-бутанол; г) бутан; д) 2-бутен.
6. Взаимодействие воды с алкенами протекает по правилу Марковникова или против него?
7. Какое вещество преимущественно образуется при присоединении брома к 1,3-бутадиену при температуре минус 80 °С? А при температуре + 40 °С? Приведите уравнения реакций.
Приведите схемы алкилирования хлорбензола, фенола, нитробензола. Расположите эти соединения в ряд по увеличению скорости реакции.
9. Следующие соединения расположите в ряд по увеличению реакционной способности при бромировании их в бензольное кольцо: а) бензол; б) фенол; в) бензальдегид; г) этилбензол. Дайте объяснения.
Определите положения, по которым преимущественно будет проходить нитрование м- нитротолуола и п- нитротолуола. Отметьте тип ориентации заместителей (совпадающая или несовпадающая).
ТЕМА 6. Конкурирующие реакции нуклеофильного замещения
и элиминирования у насыщенного атома углерода
Реакции нуклеофильного замещения у sp3- гибридизованного атома углерода: гетеролитические реакции, обусловленные поляризацией s- связи углерод - гетероатом (галогенопроизводные, спирты).
Эти реакции протекают по механизму нуклеофильного замещения.
Для первичных и вторичных соединений предполагается механизм нуклеофильного замещения второго порядка (SN2), для третичных веществ – нуклеофильного замещения первого порядка (SN1).
 |
В случае первичных и вторичных алкилгалогенидов отрицательно заряженная гидроксильная группа атакует положительно заряженный атом углерода со стороны, противоположной отрицательно заряженному атому брома. При наличии достаточной энергии гидроксил приближается настолько, что между ним и атомом углерода начинает образовываться связь, а связь между атомами углерода и иода начинает разрываться. В этом переходном состоянии атом углерода и все три водородных атома находятся в одной плоскости (молекула «уплощена»). Затем анион иода выталкивается и образуется молекула метилового спирта. Такой процесс носит название реакции нуклеофильного замещения второго порядка (SN2): нуклеофильного потому, что атакующая частица заряжена отрицательно; второго порядка — т.к. скорость реакции зависит от концентрации и йодистого метила, и гидроксила. Если исходное соединение было оптическим активным, то в процессе реакции произойдёт обращение конфигурации: например, при гидролизе D-2-бромбутана образуется L-2-бутанол.
У третичных алкилгалогенидов подход отрицательно заряженной частицы затруднен имеющимися объемными заместителями, и процесс идет по другому механизму. Хотя и в очень малой степени, но все же происходит процесс диссоциации третичного бромистого бутила:
(CH3)3C – Br « (CH3)3C+ + Br- (очень медленно)
Образующийся третичный бутилкатион мгновенно реагирует с находящимися в растворе нуклеофильными частицами:
(CH3)3C+ + HO- ® (CH3)3C – OH (очень быстро)
В этом случае скорость реакции зависит только от процесса диссоциации и, следовательно, от концентрации в реакционной смеси третичного бромистого бутила и реакция в целом называется реакцией нуклеофильного замещения первого порядка - sn1. Если в реакцию вступает оптически активное соединение, то в результате образуется оптически неактивная рацемическая смесь.
Хорошо уходящие группы – это такие группы, протонированные формы которых соответствуют сильным кислотам, например: Hal–, H2O, ROH, NH3 (протонированные формы: галогеноводородные кислоты HHal, ионы: гидроксония Н3О+, алкилоксония ROH2+, аммония NH4+ — сильные кислоты).
Плохо уходящие группы – это такие группы, протонированные формы которых соответствуют слабым кислотам, например: OH–, NH2–, SH–, OR– и др. В этом случае для протекания реакций необходимо протонирование, т.е. кислотный катализ, что позволит перевести плохоуходящую группу в хорошоуходящую.
На последней (быстрой) стадии реакции замещения происходит конкуренция за карбкатион между двумя частицами: галогенид-ионом (если в качестве кислоты использовали галогеноводородную кислоту) и молекулой воды, выступающей в роли акцептора протона. В первом случае происходит нуклеофильное замещение (SN) гидроксила на галоген, а во втором — элиминирование (Е) — отщепление протона.
Контрольные задания
1. Хлорэтон (1,1,1-трихлоро-2-метил-2-пропанол) оказывает общеуспокаивающее действие. Способно ли это лекарственное средство подвергаться щелочному гидролизу? Если да, приведите уравнение реакции.
2. К какому типу относится реакция гидролиза галогенпроизводных:
а) электрофильное присоединение; б) нуклеофильное замещение;
в) элиминирование; г) электрофильное замещение; д) радикальное замещение.
3. L-2-бромбутан реагирует с водным раствором гидроксида натрия по механизму SN2. Предскажите стереохимический результат реакции (укажите конфигурацию образующегося спирта): а) D - 2-бутанол; б) L-2-бутанол; в) рацемическая смесь; г) 2-бутен. Выберите определение рацемической смеси: 1) смесь эквимольных количеств оптически активных энантиомеров; 2) смесь эквимольных количеств геометрических (цис-, транс-) изомеров; 3) смесь эквимольных количеств оптически неактивных изомеров; 4) смесь эквимольных количеств исходного соединения и продукта реакции.
4. 1-Бромбутан гидролизуется водным раствором гидроксида натрия. Выберите название продукта реакции: а) D-1-бутанол; б) L- 1-бутанол; в) R-2-бутанол; г) S-2-бутанол; д) оптически неактивный 1-бутанол; е) оптически неактивный 2-бутанол; ж) оптически неактивный бутилат натрия. По какому механизму протекает эта реакция: 1) мономолекулярное нуклеофильное замещение; 2) бимолекулярное нуклеофильное замещение; 3) ароматическое электрофильное замещение; 4) радикальное замещение; 5) электрофильное присоединение; 6) элиминирование.
5. При взаимодействии R-2-бутанола с бромоводородом был получен S-2-бромбутан. По какому механизму прошла реакция: 1) мономолекулярное нуклеофильное замещение; 2) бимолекулярное нуклеофильное замещение; 3) ароматическое электрофильное замещение; 4) радикальное замещение; 5) электрофильное присоединение; 6) элиминирование.
6. 2-Хлорпропан гидролизуется по механизму SN2. Будет ли оптически активным продукт реакции? Почему?
ТЕМА 7. Нуклеофильные реакции в ряду карбонильных соединений
Реакции нуклеофильного замещения с участием sр2-гибридизованного атома углерода.
Механизм реакций этого типа рассмотрим на примере взаимодействия карбоновых кислот со спиртами (реакция этерификации). В карбоксильной группе кислоты реализуется р,p- сопряжение, поскольку пара электронов атома кислорода гидроксильной группы ОН вступает в сопряжение с двойной углерод-кислородной связью (p-связью):
Такое сопряжение является причиной, с одной стороны, повышенной кислотности карбоксильных соединений, а с другой уменьшения частичного положительного заряда (d+) на атом углерода карбоксильной группы (sр2-гибридизованном атоме) что значительно затрудняет непосредственную атаку нуклеофила.

 С целью увеличения заряда на атоме углерода используют дополнительное протонирование — кислотный катализ (стадия I):
С целью увеличения заряда на атоме углерода используют дополнительное протонирование — кислотный катализ (стадия I):
 | |||
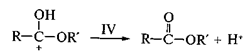 | |||
На стадии II происходит атака нуклеофила (молекулы спирта R'OH), протонирование гидроксильной группы с образованием хорошо уходящей группы Н2О, на стадии III — ее отщепление и на стадии IV — регенерация протона — возврат катализатора с образованием конечного продукта — сложного эфира.
Реакции нуклеофильного присоединения. Наиболее характерны реакции нуклеофильного присоединения (AN) для оксосоединений — альдегидов и кетонов. Механизм этих реакций имеет общие черты, это двухстадийный ионный процесс. Первая стадия (лимитирующая) представляет собой обратимую атаку нуклеофилом (Nu) с образованием так называемого тетраэдрического интермедиата. Вторая стадия — быстрая атака электрофилом:

На реакционную способность оксосоединения оказывает влияние природа групп R и R'. Так, введение электронодонорных заместителей снижает реакционную способность, а электроноакцепторных — усиливает. Поэтому альдегиды более активны в реакциях AN, чем кетоны. Кроме того, реакционная способность зависит от природы нуклеофила. Например, тиолы RSH, являясь более сильными нуклеофилами, чем спирты ROH, вступают в реакцию AN как с альдегидами, так и с кетонами, образуя устойчивые к гидролизу тиоацетали, тогда как ацетали — продукты присоединения спиртов к альдегидам — к гидролизу не устойчивы
 |
Обратите внимание, что последние стадии процесса представляют собой атаку нуклеофила (молекулы спирта R'OH) на электрофильный реакционный центр (карбкатион) и идут по механизму нуклеофильного замещения SN. Образующиеся промежуточные соединения — полуацетали — являются неустойчивыми. Стабилизация их возможна только в циклической форме при образовании циклических полуацеталей, например 5-гидроксипентаналя:
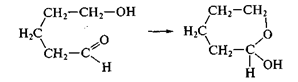 |
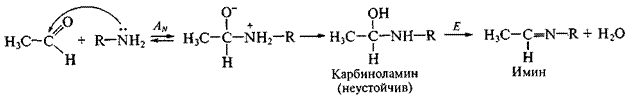 Другой пример биологически важной реакции этого типа - присоединение аминов и некоторых других азотсодержащих соединений к карбонильным соединениям – альдегидам и кетонам. Реакция идет по механизму нуклеофильного присоединения – эли минирования (AN—E):
Другой пример биологически важной реакции этого типа - присоединение аминов и некоторых других азотсодержащих соединений к карбонильным соединениям – альдегидам и кетонам. Реакция идет по механизму нуклеофильного присоединения – эли минирования (AN—E):
Другие азотсодержащие соединения, выступающие в этих реакциях в роли нуклеофила: гидразин NH2–NH2, фенилгидразин, С6Н5–NH–NH2,гидроксиламин NH2–ОН.
Продуктами реакций AN—E этих случаях являются соединения, называемые гидразонами, фенил-гидразонами, оксимами.
 Реакции конденсации. Протекают в присутствии катализаторов, чаще щелочной природы. Приводят к усложнению углеродного скелета. Характерным примером являются альдольная и кротоновая конденсации:
Реакции конденсации. Протекают в присутствии катализаторов, чаще щелочной природы. Приводят к усложнению углеродного скелета. Характерным примером являются альдольная и кротоновая конденсации:
Реакции нуклеофильного замещения в ряду карбоновых кислот.
Только с чисто формальных позиций можно рассматривать карбоксильную группу как комбинацию карбонильной и гидроксильной функций. Фактически их взаимное влияние друг на друга таково, что полностью изменяет их собственные свойства.
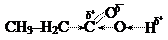 Поляризация двойной связи С=О сильно возрастает за счет дополнительного сдвига свободной электронной пары с соседнего атома кислорода гидроксильной группы:
Поляризация двойной связи С=О сильно возрастает за счет дополнительного сдвига свободной электронной пары с соседнего атома кислорода гидроксильной группы:
Следствием является значительное ослабление связи О–Н в гидроксиле и легкость отщепления атома водорода от него в виде протона (Н+). Появление пониженной электронной плотности (d+) на центральном углеродном атоме карбоксила приводит также к оттягиванию s-электронов соседней связи С – С к карбоксильной группе и появлению (как у альдегидов и кетонов) пониженной электронной плотности (d+) на a- углеродном атоме кислоты.
Самыми слабыми кислотными свойствами обладают предельные монокарбоновые кислоты. Кислотность двухосновных, непредельных или замещённых кислот (галогенкислоты, гидрокси- и оксокислоты и т.п.) заметно выще, что определяется электроноакцепторным действием заместителей и стабилизацией промежуточного аниона.
В общем производные карбоновых кислот по сравнению с альдегидами и кетонами труднее подвергаются нуклеофильной атаке, так как электрофильность карбонильного атома углерода обычно снижается за счет - М-эффекта функционального заместителя, связанного с атомом углерода карбонильной группы. По этой причине для проведения реакций оказывается необходимым кислотный катализ – протонирование aтома кислорода карбонильной группы, что ведет к появлению дополнительного заряда на атоме углерода, что облегчает атаку нуклеофилом.
В итоге механизм катализируемой кислотой реакции по сравнению с механизмом некатализируемой реакции включает предварительную стадию протонирования и заключительную стадию депротонирования.
Реакции конденсации, в основе которых лежит способность одного карбонильного соединения присоединяться к карбонильной группе этого же или другого карбонильного вбединения, характерны и для производных карбоновых кислот, в частности рюжных эфиров и тиоэфиров. Такие реакции имеют большое биологическое значение. С их помощью в организме происходит образование новых связей углерод—углерод. Непременными участниками реакций по типу альдольного присоединения in vivo являются тиоэфиры карбоновых кислот — производные кофермента А. При конденсации ацетилкофермента А по типу альдольного присоединения из двух молекул ацетилкофермента А образуются ацетоацетилкофермент А и кофермент А.
Контрольные задания
1. Примером биологически важной реакции является присоединение аминов и некоторых других азотсодержащих соединений к карбонильным соединениям – альдегидам и кетонам. Напишите уравнение присоединения гидразина к пентаналю. Назовите продукт реакции. Поясните, можно ли с помощью этой реакции провести выделение и идентификацию пентаналя?
2. Наличие какой функциональной группы в молекуле формальдегида подтверждает реакция получения его динитрофенилгидразона:
а) карбоксильной; б) гидроксильной; в) карбонильной; г) метильной; д) атома водорода.
3. Для чего можно использовать реакцию альдегида с динитрофенилгидразином:
1) идентификации альдегида; 2) окисления альдегида; 3) восстановления альдегида; 4) выделения альдегида из смеси с карбоновой кислотой; 5) выделения альдегида из смеси с кетоном.
4. Приведите формулу изомера пропаналя. Будут ли для него характерны те реакции нуклеофильного присоединения, которые характерны для пропаналя?
Дата добавления: 2014-04-05; просмотров: 1338; Нарушение авторских прав

Мы поможем в написании ваших работ!