
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
По электронной природе реагентов (нуклеофильные, электрофильные, свободнорадикальные реакции)
Нуклеофильные реагенты – это одно- или многоатомные анионы или молекулы, имеющие центры с повышенной электронной плотностью. К ним относятся такие анионы и молекулы, как HO-, RO-, Cl-, Br-, RCOO-, CN-, R-, NH3, C2H5OH и т.д.
Электрофильные реагенты – это катионы, простые или сложные молекулы, которые сами по себе или же в присутствии катализатора обладают повышенным сродством к электронной паре или отрицательно заряженным центрам молекул. К ним относятся катионы H+, Cl+, +NO2, +SO3H, R+ и молекулы со свободными орбиталями AlCl3, ZnCl2 и т.п.
Свободные радикалы – это электронейтральные частицы, имеющие неспаренный электрон, например: Cl·, ·NO2.
По изменению числа частиц в ходе реакции (замещение, присоединение, отщепление, разложение, ОВР и др.).
В случае реакций замещения в молекуле один атом (или группа атомов) замещается другим атомом (или группой атомов), в результате чего образуются новые соединения:
СН3–СН3 + С12 ® СН3–СН2С1 + НC1
При протекании реакций присоединения из двух (или нескольких) молекул образуется одно новое вещество:
CH2 = CH2 + HBr → CH2Br–СH3
В результате реакции отщепления образуется новое органическое вещество, содержащее кратную связь:
СН3–СН2С1 + NaOH(спиртовой р-р) ® СН2 = СН2 + NaC1 + Н2О
Реакции разложения приводят к образованию из одного вещества двух или более веществ более простого строения:
НСООН → СО2 + Н2
По частным признакам (гидратация и дегидратация, гидрирование и дегидрирование, нитрование, сульфирование, галогенирование, ацилирование, алкилирование, карбоксилирование и декарбоксилирование, енолизация, замыкание и размыкание циклов, изомеризация, окислительная деструкция, пиролиз, полимеризация, конденсация и др.).
4. По механизмам элементарных стадий реакций (нуклеофильное замещение SN, электрофильное замещение SE, свободнорадикальное замещение SR, парное отщепление, или элиминирование Е, нуклеофильное или электрофильное присоединение AdE и AdN и т. д.).
Рассмотрим несколько примеров.
Пример 1.При действии на организм больших доз гидразина или его производных наблюдаются нервные расстройства. Какова химическая основа действия гидразина, если известно, что он реагирует с коферментом пиридоксальфосфатом?
Решение. Пиридоксальфосфат — гетероциклическое соединение, содержащее в цикле наряду с другими заместителями альдегидную группу. Гидразин NH2–NH2 как нуклеофильный реагент взаимодействует с карбонильным атомом углерода. Поляризованная p-связь карбонильной группы легко разрывается, и между карбонильным атомом углерода и атомом азота возникает ковалентная связь донорно-акцепторного типа за счет пары электронов атома азота молекулы гидразина.
 |
Образующийся диполярный ион в результате перехода протона от положительно заряженного атома азота (кислотный центр) к аниону (основный центр) превращается в нейтральное соединение. В этом соединении у атома углерода содержатся одновременно две электроноакцепторные группы, поэтому оно неустойчиво и переходит в более стабильное состояние путем отщепления молекулы воды. Конечным продуктом описанной реакции присоединения-отщепления является гидразон пиридоксальфосфата.
Образование гидразона приводит к блокированию альдегидной группы пиридоксальфосфата, что нарушает его взаимодействие как кофермента с аминогруппой глутаминовой кислоты. Эта реакция является одним из этапов превращения в организме глутаминовой кислоты в g-аминомасляную. Блокирование же кофермента гидразином приводит к недостатку g-аминомасляной кислоты, тормозящей проведение нервных импульсов.
Пример 2. В процессе метаболизма в живых организмах фумаровая кислота превращается в яблочную. Каким путем можно получить яблочную кислоту из фумаровой в условиях in vitro?
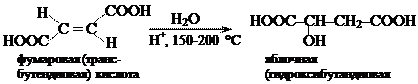 Решение. Фумаровая кислота — ненасыщенная двухосновная кислота, которую можно рассматривать как замещенный алкен. Яблочная кислота принадлежит к насыщенным двухосновным гидроксикислотам.
Решение. Фумаровая кислота — ненасыщенная двухосновная кислота, которую можно рассматривать как замещенный алкен. Яблочная кислота принадлежит к насыщенным двухосновным гидроксикислотам.
Переход от фумаровой кислоты к яблочной осуществляют путем присоединения воды по кратной связи, т. е. с помощью реакции гидратации. Гидратацию алкенов проводят в разбавленном водном растворе сильной кислоты, например серной. Кислота служит источником электрофильной частицы — протона Н+.
Электронная плотность углерод-углеродной p-связи в молекуле фумаровой кислоты уменьшена вследствие электроноакцепторного действия двух карбоксильных групп. Поэтому гидратацию фумаровой кислоты осуществляют в сравнительно жестких условиях (нагревание с разбавленным водным раствором кислоты при температуре 150-200 °С).
Гидратация фумаровой кислоты протекает по обычному для алкенов механизму электрофильного присоединения АЕ. Протон взаимодействует с кратной связью в молекуле фумаровой кислоты. Образовавшийся карбокатион атакуется нуклеофильным реагентом – молекулой воды. Алкилоксониевый ион, являясь сильной кислотой, отщепляет протон (возврат катализатора). В результате образуется продукт реакции – яблочная кислота.
Гидратация фумаровой кислоты in vitro приводит к образованию рацемата – смеси равных количеств двух энантиомеров яблочной кислоты. В организме эта реакция катализируется ферментом фумаразой, для которого характерна строгая пространственная специфичность, что ведет к образованию только L-яблочной кислоты. Это пример селективного (избирательного) протекания реакции.
Направление химической реакции определяется совокупностью многих факторов.
Статические факторы. Реакционная способность соединений существенно зависит от распределения в их молекулах электронной плотности, которое в свою очередь определяется электронными эффектами заместителей и наличием сопряженных и ароматических фрагментов. Характерная для большинства соединений неравномерность в распределении электронной плотности является причиной появления в молекуле реакционных центров, предопределяющих направление атаки тем или иным реагентом (электронный фактор).
Пространственное строение молекулы определяет пространственный фактор, когда из-за относительно большого пространственного объема заместителей, окружающих реакционный центр, к нему может быть затруднен подход атакующей частицы. При этом реакция либо не будет осуществляться совсем, либо будет идти по иному направлению с участием другого, более доступного реакционного центра, если он имеется в молекуле.
Динамические факторы. Многостадийные процессы обычно включают стадии промежуточного образования нестабильных интермедиатов, обладающих высокой реакционной способностью. Часто можно предположить образование не одного, а нескольких интермедиатов. Реакция предпочтительно будет проходить через стадию образования относительно более устойчивого интермедиата. Относительная устойчивость интермедиатов, в частности часто выступающих в качестве высокореакционных промежуточных частиц карбокатионов, карбанионов и свободных радикалов, определяется возможностью делокализации в этих частицах электронной плотности.
Селективность реакций
Во многих случаях в органическом соединении присутствуют несколько неравноценных реакционных центров. В зависимости от строения продуктов реакции говорят о региоселективности, хемоселективности и стереоселективности реакции.
Региоселективность — предпочтительное протекание реакции по одному из нескольких реакционных центров молекулы.
Например, при взаимодействии пропана с бромом при УФ облучении в реакции преимущественно участвует один реакционный центр — связь С—Н вторичного атома углерода.
 СН3—СН2—СН3 + Вr2 hv 120°С СН3—СНВr—СН3 + НВr
СН3—СН2—СН3 + Вr2 hv 120°С СН3—СНВr—СН3 + НВr
Пропан 2-Бромпропан
Второй возможный изомер, 1-бромпропан, в этом процессе практически не образуется.
Хемоселективность — предпочтительное протекание реакции по одной из родственных функциональных групп.
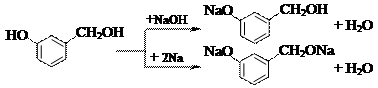 Например, из двух нижеприведенных реакций с участием п-гидроксибензилового спирта только взаимодействие его с гидроксидом натрия относится к хемоселективным процессам.
Например, из двух нижеприведенных реакций с участием п-гидроксибензилового спирта только взаимодействие его с гидроксидом натрия относится к хемоселективным процессам.
Стереоселективность — предпочтительное образование в реакции одного из нескольких возможных стереоизомеров.
Например, при катализируемом ферментом присоединении воды к фумаровой кислоте in vivo образуется только один из двух возможных здесь стереоизомеров — L-яблочная кислота
На способность соединений вступать в реакции также оказывают влияние индукционный и мезомерный эффекты заместителей.
Контрольные задания
1. Какая из кислот обладает самыми сильными кислотными свойствами:
а) уксусная; б) трибромуксусная; в) бромуксусная; г) стеариновая?
2. Какой электронный эффект атома галогена является причиной изменения кислотности у галогенсодержащих кислот: 1) положительный индукционный, 2) отрицательный индукционный, 3) положительный мезомерный, 4) отрицательный мезомерный?
3. Какое из соединений обладает более выраженными основными свойствами:
а) метиламин, б) диметиламин, в) анилин, г) 4-нитроанилин.
4. Укажите электронные эффекты (электронный эффект) метильного радикала:
1) положительный мезомерный; 2) отрицательный мезомерный; 3) нет эффекта,
4) положительный индуктивный; 5) отрицательный индуктивный.
5. К какому типу относится реакция гидролиза галогенпроизводных углеводородов:
СН3–СН2С1 + NaOH(водный р-р) ® СН3–СН2ОН + NaC1
а) электрофильное присоединение; б) нуклеофильное замещение;
в) элиминирование; г) электрофильное замещение; д) радикальное замещение.
6. По какому механизму протекает реакция синтеза кислоты из альдегида:
а) радикального замещения; б) нуклеофильного присоединения;
в) радикального присоединения; в) электрофильного присоединения;
г) электрофильного замещения; д) окисления-восстановления?
7. При обесцвечивании пропеном бромной воды образуется: 1,2-дибромпропан
К какому типу реакций относится взаимодействие пропена с водой в присутствии серной кислоты: 1) замещение; 2) элиминирование; 3) разложение; 4) присоединение
ТЕМА 5. Радикальные и электрофильные реакции органических соединений
Радикальные реакции.
Хлор реагирует с предельными углеводородами только под влиянием света, нагревания или в присутствии катализаторов, причем последовательно замещаются хлором все атомы водорода:
СН4 + С12 ® СН3С1 + НС1
СН3С1 + С12 ® СН2С12 + НСl
СН2С12 + С12 ® CHC13 + HCl
СНС13 + С12 ® СС14 + НСl
Наиболее легко замещается водород у третичного атома углерода. Соотношение между скоростями замещения (при 300°) водородных атомов при первичном, вторичном и третичном атомах углерода 1 : 3, 25 : 4,3.
Реакция протекает по цепному радикальному механизму.
С12 ® 2С1. зарождение цепи
СН3 – Н + C1.® CH3. + HC1 рост, развитие цепи
СН3. + С12 ® СН3С1 + C1. рост, развитие цепи
2С1. ® С12 обрыв цепи
СН3. + С1. ® СН3С1 обрыв цепи
СН3. + СН3. ® С2Н6 обрыв цепи
Фотохимическое бромирование обычно проходит строго избирательно (селективно) – легче всего замещаются атомы водорода у третичного атома углерода.
Существуют три общих пути генерирования радикальных частиц: расщепление ковалентной связи за счет тепловой энергии (термолиз); расщепление связи при помощи лучистой энергии (фотолиз) и образование радикалов в окислительно-восстановительных процессах.
При сильном нагревании (500°С и выше) тепловой энергии оказывается достаточно для разрыва прочных С—С и С—Н связей. Поэтому большинство процессов при высоких температурах (пиролиз, крекинг) протекает по радикальному механизму.
Облучение видимым или ультрафиолетовым светом часто используется для избирательного (селективного) расщепления относительно слабых связей. Образующиеся при этом радикальные частицы выступают в качестве инициаторов последующих превращений.
Радикальные реакции весьма распространены и в живых системах, так как молекулярный кислород является одним из самых распространенных радикалов и сам способен инициировать радикальные реакции. Известно, что в основном состоянии молекула кислорода представляет собой бирадикал, в котором на каждом атоме кислорода находится по одному неспаренному электрону. Как и другие радикалы, кислород может отрывать Н-атом от углеводородного фрагмента и служить таким образом одним из инициаторов радикальных реакций. В качестве примера можно назвать процессы горения, а также автоокисления, в том числе и в биологических системах.
Когда молекулярный кислород принимает электрон, он превращается в анион-радикал О2-·, называемый супероксидом (superoxide). Этот радикал способен участвовать как в полезных, так и в нежелательных физиологических процессах. Например, иммунная система живого организма использует супероксид в своей борьбе с патогенами - чужеродными болезнетворными телами. Вместе с тем супероксид может быть вовлечен в некоторые процессы, вызывающие окислительное повреждение здоровых клеток, что ведет к дегенерации и старению живого организма. Нормальное функционирование системы ферментов предотвращает эти нежелательные процессы.
Один из таких ферментов - супероксид дисмутаза - регулирует уровень супероксида в организме, катализируя его превращение в пероксид водорода и молекулярный кислород. Пероксид водорода, однако, также опасен, поскольку может генерировать гидроксильные радикалы ×ОН.
Гидроксильный радикал в биологических системах возникает и при неполном восстановлении молекулы кислорода
О2 + 3е- + 3Н+ ® НО× + Н2О
Пероксидные радикалы возникают при взаимодействии молекулы кислорода с ионами тяжелых металлов, например ионами железа(II)
Fe2+ + О2 + Н+ ® Fe3+ + Н–О–О× гидропероксильный радикал
Пероксильные и гидроксильные радикалы действуют избирательно (селективно), атакуя в ненасыщенных высших кислотах связи С—Н метиленовых групп, соседних с двойной связью. При этом образуются наиболее стабильные в данном случае радикалы аллильного типа.
С6Н13СН(ОН)–СН2–СН=СН–СН2–(СН2)6СООН ®
С6Н13СН(ОН)– ×СН–СН=СН–СН2–(СН2)6СООН + С6Н13СН(ОН)–СН2–СН=СН–×СН–(СН2)6СООН
Свободные радикалы аллильного типа могут вступать в различные реакции, в частности с молекулами кислорода и воды, с образованием гидропероксидов.
Аллильный радикал + О2 ® С6Н13СН(ОН)– (×ОО)СН–СН=СН–СН2–(СН2)6СООН
Пероксильный радикал + Н2О ® С6Н13СН(ОН)– (НОО)СН–СН=СН–СН2–(СН2)6СООН + ×ОН
Гидропероксиды неустойчивы. Они подвергаются дальнейшим превращениям. При этом сначала образуются альдегиды, которые легко окисляются в кислоты. Таким образом, наличие свободных радикалов в организме вызывает цепь реакций, изменяющих структуру и, следовательно, функции кислоты.
Ненасыщенные высшие жирные кислоты — структурные компоненты клеточных мембран. Свободные радикалы являются мощным фактором, повреждающим клеточные мембраны.
Фермент каталаза, также присутствующий в живом организме, предотвращает образование ·ОН-радикалов.
Эти процессы, протекающие в живой клетке, показывают, что в соответствующих ситуациях важным является не только инициирование, но и ингибирование радикальных реакций.
В живых организмах ингибиторами окислительных реакций также могут выступать природные антиоксиданты - гидрокси- и полигидроксисоединения.
Например, a-токоферол (витамин Е) действует как ловушка

витамин Е (a-токоферол) витамин С
радикалов и ингибирует нежелательные радикальные процессы в организме, способные вызвать повреждение клеток.
Витамин С также является антиоксидантом, эффективно работающим в живых системах. Тем не менее и этим антиоксидантом нельзя злоупотреблять: не следует принимать более 500 мг витамина С однократно .
Реакции электрофильного присоединения
Ненасыщенные углеводороды — алкены, циклоалкены, алкадиены и алкины — проявляют способность к реакциям присоединения, так как содержат двойные или тройные связи. Более важной in vivo является двойная связь.
За счет электронов p-связи в молекулах алкенов имеется область повышенной электронной плотности. Поэтому они представляют собой нуклеофилы и, следовательно, склонны подвергаться атаке электрофильным реагентом.
Механизм реакции. Присоединение к алкенам галогеноводородов и родственных соединений протекает по гетеролитическому электрофильному механизму ае. Электрофильной частицей в данном процессе часто служит простейший электрофил — протон Н+. В реакции выделяют две основные стадии: 1) электрофильная атака протоном алкена с образованием карбокатиона — медленная стадия, определяющая скорость процесса в целом; 2) атака образовавшегося карбокатиона нуклеофилом Х—, приводящая к конечному продукту (быстрая стадия).
Присоединение галогеноводородов и воды (гидратация) происходит по правилу Марковникова: атомы водорода присоединяются преимущественно к наиболее гидрогенизированному атому углерода (наиболее богатому водородом), а атом галогена или гидроксигруппа присоединяются к наименее гидрогенизированному.
Н3С–СН = СН2 + НCl ® Н3С–СНCl–СН3
Образуется преимущественно 2-хлорпропан, а не 1-хлорпропан.
Но такая формулировка правила Марковникова не объясняет направление реакций гипогалогенирования (присоединения НОГал) и реакций присоединения к алкенам, в состав которых входят группы, обладающие отрицательным мезомерным или индукционным эффектами.
Существует и другая более общая формулировка правила Марковникова: присоединение несимметричного реагента к несимметричному алкену по ионному механизму протекает в направлении образования более устойчивого катиона. Так, в результате присоединения катиона водорода к двойной связи пропена могут возникнуть два карбокатиона:
СН3®СН2®+СН2 (I) и СН3®+СН¬СН3 (II)
Ни в том, ни в другом катионе положительный заряд на выделенном атоме углерода не равен, а много меньше +1 из-за смещения к нему электронной плотности от соседних атомов. Но в первичном катионе (I) донором этой плотности является один, а во вторичном (II) – два соседних атома углерода. Кроме того, в первичном катионе (I) метильная группа находится дальше, ее индукционный эффект по цепи затухает. Это значит, что распределение заряда во вторичном карбокатионе (II) более равномерное; такая частица оказывается более устойчивой, реакция идет по пути, направляемому ее образованием.
Рассмотрим присоединение галогеноводорода к непредельным карбоновым кислотам:
СН2 = СН – СООН + НCl ® СН2Cl – СН2 – СООН
В этом случае водород присоединяется к менее гидрогенизированному атому углерода. Значит ли это что присоединение идет против правила Марковникова? Оказывается, нет. В результате присоединения иона водорода к двойной связи кислоты могут возникнуть два карбокатиона:
+СН2 – СН2 ® СООН (I) и СН3 ®+СН ®СООН (II)
В первичном катионе (I) нет донорной метильной группы, зато дестабилизирующее действие акцепторной карбоксильной группы ощущается заметно меньше, чем во вторичном катионе (II). Отрицательный мезомерный и индукционный эффекты в карбоксильной группе увеличивают положительный заряд во вторичном катионе (II) в большей степени, чем в первичном (I). Это значит, что распределение заряда в первичном карбокатионе (I) более равномерное; такая частица оказывается более устойчивой, реакция идет по пути, направляемому ее образованием. Присоединение фактически следует правилу Марковникова в его обобщенной форме.
В случае реакции гипохлорирования (присоединения HOCl) в растворе присутствуют ионы ОН- и Cl+, а протона нет совсем и применима только обобщенная формулировка правила Марковникова. Тогда в результате присоединения катиона хлора к двойной связи пропена могут возникнуть два карбокатиона, из которых более устойчивым будет являться вторичный (II):
СН3®СНCl ®+СН2 (I) и СН3®+СН ¬ СН2Cl (II)
Тогда реакцию можно записать следующим образом:
Н3С–СН=СН2 + НОCl ® Н3С–СН(ОН)–СН2Cl
Присоединение против правила Марковникова идет в том случае, если реакцию проводят в присутствии перекисей (Н2О2 или ROOR). Тогда реакция протекает по другому механизму (свободнорадикальное присоединение):
 Н3С–СН=СН2 + НBr ROOR Н3С–СН2–СН2Br
Н3С–СН=СН2 + НBr ROOR Н3С–СН2–СН2Br
Для сопряженных диенов характерна способность образовывать в реакциях присоединения наряду с обычными 1,2-аддуктами продукты 1,4-присоединения. Соотношение между ними в значительной степени зависит от условий эксперимента.
Реакции электрофильного замещения. Для ароматических соединений бензольного ряда, конденсированных и гетероциклических ароматических соединений характерны реакции, не приводящие к нарушению ароматической системы, т. е. реакции замещения. Они не склонны вступать в реакции присоединения или окисления, ведущие к нарушению ароматичности.
Для соединений ароматического характера, имеющих замкнутую p -электронную систему, наиболее характерны реакции с электрофильными агентами.
С помощью кинетических методов показано, что большинство реакций электрофильного замещения в ароматическом ряду протекает по двухстадийному механизму. На первой, медленной, стадии происходит нарушение ароматической системы и переход атакуемого атома углерода ядра в состояние sp3-гибридизации. Вторая, быстрая, стадия сопровождается восстановлением ароматической структуры и вследствие выигрыша энергии протекает легко и быстро.

Следует заметить, что протекание первой стадии обычно осуществляется с промежуточным образованием так называемого p-комплекса. p -Комплексы представляют собой координационные соединения, в которых донором являются ароматические соединения, имеющие легко поляризуемые p -электроны, а акцепторами – галогены, сильные минеральные кислоты и тому подобные соединения, имеющие по разным причинам сродство к электронам.
p-Комплексы не являются истинными химическими соединениями, в которых электрофильная частица связывается ковалентной связью с конкретным атомом субстрата. p -Комплексы, образуемые бензолом, очевидно, построены объемно, так как наибольшая p-электронная плотность ароматических соединений расположена по обе стороны бензольного кольца.
Первой ступенью взаимодействия ароматических соединений с электрофильным агентом Е+ при реакциях электрофильного замещения является образование p- комплекса, который медленно, лимитируя скорость всей реакции, перегруппировывается в карбкатион (s- комплекс).
В отличие от p-комплексов, s-комплексы представляют собой истинно химические соединения, в которых электрофильный агент Е+ образует ковалентную связь за счет двух p-электронов одной из связей бензольного кольца. При образовании s-комплекса электрофильный агент внедряется в ароматическую молекулу более «глубоко», чем в p-комплексе. В s-комплексе один из атомов углерода бензольного кольца переходит в состояние sp 3-гибридизации, в котором все четыре связи направлены под углом 109°. При этом нарушается симметрия бензольного кольца, а группа Е+ и атом водорода оказываются в положении, перпендикулярном плоскости кольца.
Реакции электрофильного замещения завершаются отщеплением от s-комплекса протона и восстановлением ароматической системы. Как правило, этот процесс происходит при участии обладающего основными свойствами аниона А–, присутствующего в реакционной среде, и сопровождается выделением энергии.
К реакциям электрофильного замещения относятся реакции галогенирования, нитрования, сульфирования, алкилирования, ацилирования:
 |
Заместители в кольце делят на ориентанты I рода и II рода. Ориентанты I рода: алкильные радикалы, группы –ОН, –OR, –NH2, –NHR, –NR2, –SH, атомы галогенов направляют второй заместитель в орто- и пара-положения. Все заместители I рода, кроме галогенов, обладают электронодонорными свойствами по отношению к бензольному кольцу и ускоряют реакции электрофильного замещения по сравнению с незамещённым бензолом.

Ориентанты II рода: карбонильные и сложноэфирные группы, группы –СООН, –SO3H, –NO2, –CºN направляют второй заместитель в мета-положение. Все заместители II рода обладают электроноакцепторными свойствами по отношению к бензольному кольцу и замедляют реакции электрофильного замещения по сравнению с незамещённым бензолом.
Контрольные задания
1. Укажите, какая из стадий хлорирования метана на свету показывает обрыв цепи:
а) СН4 + С1× ® ×СН3 + НС1; б) ×СН3 + С12 ® СН3С1 + Сl×;
в) СН3С1+С1× ® ×СН2С1+НС1; г) ×СН3 + ×СН3 ® CH3 – CH3.
К какому типу относится эта реакция?
| <== предыдущая страница | | | следующая страница ==> |
| На рисунке представлена формула фумаровой кислоты. Приведите структурную формулу малеиновой кислоты, являющейся p-диастереомером фумаровой | | | Напишите уравнения бромирования, сульфирования, и нитрования бутана |
Дата добавления: 2014-04-05; просмотров: 1530; Нарушение авторских прав

Мы поможем в написании ваших работ!