
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лекция № 5. ФЕРМЕНТЫ (продолжение)
1.Ингибиторы ферментативной активности.
2.Виды ИНГИБИРОВАНИЯ.
3.Активаторы ферментов.
4.Понятие об ИЗОФЕРМЕНТАХ.
ИНГИБИТОРЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ.
Ферменты - это катализаторы с регулируемой активностью. Ею можно управлять с помощью различных веществ. Действие фермента можно подавить или частично, или полностью, т.е. ИНГИБИРОВАТЬ определёнными химическими веществами, находящимися в организме или поступающими извне. Эти вещества называются ИНГИБИТОРАМИ.
По характеру действия ингибиторы делятся на 2 большие группы:
1.Обратимые - это соединения, которые НЕКОВАЛЕНТНО взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации.
2.Необратимые - это соединения, которые могут специфически связывать определенные функциональные группы активного центра фермента. Они образуют с ним прочные КОВАЛЕНТНЫЕ связи, поэтому такой комплекс трудно разрушить.
ВИДЫ ИНГИБИРОВАНИЯ. По механизму действия выделяют следующие виды ИНГИБИРОВАНИЯ:
1. КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное связыванием с активным центром фермента ингибитора, который по своей структуре близок к структуре субстрата. При этом и субстрат, и ингибитор могут взаимодействовать с ферментом, но они будут конкурировать за активный центр фермента, и связываться будет то вещество, которого больше.

ПРИМЕР: СУКЦИНАТДЕГИДРОГЕНАЗНАЯ реакция.
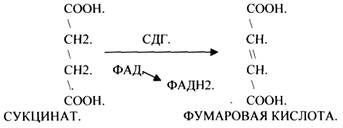
Конкурентным ингибитором данной реакции является МАЛОНОВАЯ кислота, поэтому с активным центром фермента связывается и та, и другая кислота, в зависимости от их соотношения в растворе. Чтобы снять частично или полностью действие конкурентного ингибитора, нужно повысить концентрацию субстрата. При этом весь фермент будет находиться в форме фермент-субстратного комплекса, а доля комплекса фермент-ингибитор будет резко понижаться, поэтому скорость ферментативной реакции может быть максимальной даже в присутствии ингибитора. Многие лекарственные препараты действуют по типу конкурентного ингибитора. При этом они тормозят активность ряда ферментов, необходимых для функционирования бактериальных клеток. Примером является применение СУЛЬФАНИЛА (СА). При различных инфекционных заболеваниях, которые вызываются бактериями, применяются СА препараты. Эти препараты имеют структурное сходство с ПАРААМИНОБЕНЗОЙНОЙ кислотой, которая используется бактериями для синтеза ФОЛИЕВОЙ кислоты, необходимой для роста и размножения бактерий.
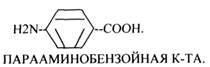

Введение СА приводит к ИНГИБИРОВАНИЮ фермента бактерий, которые синтезируют ФОЛИЕВУЮ кислоту. Нарушение синтеза этой кислоты проводит к нарушению роста микроорганизмов и их гибели.
По принципу конкурентных ингибиторов действует целая группа различных препаратов -это АНТИХОЛИНЭСТЕРАЗЫ. Они являются конкурентными ингибиторами фермента
ХОЛИНЭСТЕРАЗЫ, катализирующего ГИДРОЛИЗ АЦЕТИЛХОЛИНА. АЦЕТИЛХОЛИН обеспечивает проведение нервного импульса. АНТИХОЛИНЭСТЕРАЗЫ конкурируют с АЦЕТИЛХОЛИНОМ за активный центр фермента ХОЛИНЭСТЕРАЗЫ. В результате этого распад АЦЕТИЛХОЛИНА тормозится, он накапливается в организме, вызывая нарушение проведения нервного импульса.
2.НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное влиянием ингибитора на каталитическое превращение субстрата. При этом ингибитор не влияет на связывание фермента с субстратом. Неконкурентный ингибитор может связываться либо с каталитическими группами активного центра фермента, либо вне активного центра фермента, но при этом он изменяет КОНФОРМАЦИЮ фермента и затрагивает каталитический участок его активного центра. При неконкурентном ИНГИБИРОВАНИИ, возможно образование тройного комплекса.
В качестве неконкурентного ингибитора выступают ЦИАНИДЫ. Они прочно связываются с ионами железа, которые входят в состав каталитического ГЕМИНОВОГО фермента -ЦИТОХРОМОКСИДАЗЫ. Этот фермент является одним из компонентов дыхательной цепи. Блокирование дыхательной цепи выключает её из работы, что приводит к мгновенной гибели организме. Примером неконкурентного ингибитора являются соли тяжёлых металлов. Они блокируют -SH группы, которые входят в каталитический участок фермента. При этом образуется F-I комплекс. Он способен присоединять субстрат, но дальнейшего превращения субстрата не происходит, т.к. каталитические группы фермента заблокированы. Реакция непродуктивна. Снять действие неконкурентного ингибитора очень сложно, т.к. ионы металлов очень прочно связываются с активным центром фермента. Действие этого ингибитора можно снять только с помощью специальных веществ - РЕАКТИВАТОРОВ.
3.СУБСТРАТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное избытком субстрата. При этом образуется F-S комплекс, но он не подвергается каталитическим превращениям, т.к. делает молекулу фермента неактивной. Действие субстратного ингибитора снимается путём уменьшения концентрации субстрата.
4.АЛЛОСТЕРИЧЕСКОЕ ИНГИБИРОВАНИЕ характерно для ферментов, имеющих четвертичную структуру, молекула которых состоит из нескольких единиц (ПРОТОМЕРОВ). АЛЛОСТЕРИЧЕСКИЕ ферменты могут иметь 2 и более единиц. При этом одна имеет каталитический центр и называется каталитической, а другая - АЛЛОСТЕРИЧЕСКИЙ центр и называется регуляторной. В отсутствии АЛЛОСТЕРИЧЕСКОГО ИНГИБИТОРА субстрат присоединяется к каталитическому центру, и идёт обычная каталитическая реакция. При появлении АЛЛОСТЕРИЧЕСКОГО ИНГИБИТОРА, он присоединяется к регуляторной единице, т.е. к АЛЛОСТЕРИЧЕСКОМУ центру, и изменяет КОНФОРМАЦИЮ центра фермента, в результате этого активность фермента снижается.
АКТИВАТОРЫ ФЕРМЕНТОВ.
Это вещества, повышающие скорость ферментативной реакции. Выделяют несколько групп активаторов:
1. Соляная кислота - активатор пепсина. Желчные кислоты - активаторы ЛИПАЗЫ.
2. Ионы различных металлов
Некоторые ферменты для проявления ферментативной активности требуют присутствия ионов нескольких металлов. Ионы металлов в разных случаях могут быть или донорами, или акцепторами электронов. Некоторые ионы металлов способны присоединять субстрат к активному центру фермента, т.е. способствуют образованию F-S комплекса.
3. Активация некоторых ферментов осуществляется путём частичного ПРОТЕОЛИЗА. Эти ферменты действуют в основном в ЖКТ. Они вырабатываются в неактивной форме, а именно, в форме ПРОФЕРМЕНТА. Активация таких ферментов происходит путём разрыва одной или нескольких ПЕПТИДНЫХ связей.

Из оставшейся части, после отнятия ГЕКСАПЕПТИДА, формируется новый фермент, отличающийся по ПРОСТРАНСТВЕННОЙ КОНФИГУРАЦИИ от неактивного ТРИПСИНОГЕНА, а также формой активного центра ТРИПСИНА.
4. АЛЛОСТЕРИЧЕСКАЯ АКТИВАЦИЯ ферментов характерна для АЛЛОСТЕРИЧЕСКИХ ферментов. Активатор присоединяется к АЛЛОСТЕРИЧЕСКОМУ центру и влияет на КОНФОРМАЦИЮ активного центра фермента, делает её КОМПЛЕМЕНТАРНОЙ молекуле субстрата.
ПОНЯТИЕ ОБ ИЗОФЕРМЕНТАХ.
ИЗОФЕРМЕНТЫ - это семейство или группа ферментов, катализирующих одну реакцию, но различающихся по некоторым физико-химическим свойствам:
по А К составу;
по последовательности АК;
по молекулярной массе;
по электрофоретической подвижности;
по способам регуляции.
ИЗОФЕРМЕНТЫ называют ещё молекулярными формами фермента, причём физико-химические различия в их формах возникли, вследствие генетического различия в первичной структуре белка. Множественные формы ферментов - это модификации одного фермента, у которого различия в физико-химических свойствах возникли не вследствие генетических причин, а вследствие каких-то внешних воздействий.
ЛДГ (ЛАКТАТДЕГИДРОГЕНАЗА) имеет 5 ИЗОФОРМ, каждая из которых является ТЕТРОМЕРОМ - состоит из 4 СУБЪЕДИНИЦ Н и М типов.
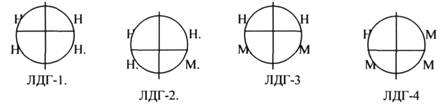

ИЗОФЕРМЕНТЫ отличаются строгой органной специфичностью. В миокарде, почках наиболее активна ЛДГ-1, ЛДГ-2. Для печени и мышц наиболее активны ЛДГ-4, ЛДГ-5. Определение активности ИЗОФЕРМЕНТОВ имеет диагностическое значение. При патологии печени в сыворотке крови резко возрастает активность ЛДГ-4, ЛДГ-5.
| <== предыдущая страница | | | следующая страница ==> |
| Лекция № 4.ФЕРМЕНТЫ (продолжение) | | | Лекция № 6. ФЕРМЕНТЫ (продолжение) |
Дата добавления: 2014-04-15; просмотров: 1108; Нарушение авторских прав

Мы поможем в написании ваших работ!