
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Законы газового состояния
Закон объемных отношений (Гей–Люссака): при неизменных температуре и давлении объемы вступающих в реакцию газов относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
Закон Авогадро: в равных объемах любых газов при одинаковых условиях (Т, р) содержится равное количество молекул.
Следствия из закона Авогадро:
1. При одинаковых условиях 1 моль любого газа занимает одинаковый объем.
2. При н.у. 1 моль различных газов занимает объем 22,4 л (молярный объем газа, л/моль).
3. Отношение масс равных объемов различных газов равно отношению их молекулярных масс:
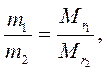
где m1 и m2 – массы, а 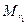 и
и 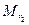 – молекулярные массы первого и второго газов.
– молекулярные массы первого и второго газов.
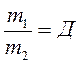 - относительная плотность первого газа по второму.
- относительная плотность первого газа по второму.
Тогда 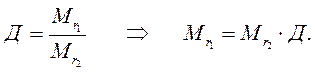
Объединенный газовый закон:
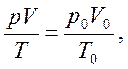
р0 = 101325 Па, Т0 = 0 ºС (273,15 К),
где р0, V0, Т0 – соответственно давление, объем, температура при н.у.; р, V, Т – те же параметры данного количества газообразного вещества при других условиях.
Для 1 моль любого газа при н.у.: 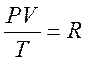 - универсальная газовая постоянная.
- универсальная газовая постоянная.
R = 8,314 Дж/(моль×К)
Для 1 моля газа тогда имеем:
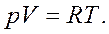
Это уравнение состояния идеального газа.
Если количество газа другое, то получим уравнение Менделеева – Клапейрона:
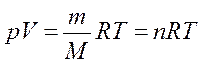 (n – число молей данного вещества).
(n – число молей данного вещества).
Закон парциальных давлений: общее давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь:
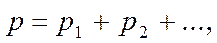
где р – общее давление; р1, р2 … - парциальные давления газов 1, 2 …
Парциальное давление газа в смеси – давление, которое производило бы это же количество данного газа, если бы он один занимал при этой же температуре весь объем, занимаемый смесью.
| <== предыдущая страница | | | следующая страница ==> |
| Основные стехиометрические законы химии | | | Строение атома |
Дата добавления: 2014-04-24; просмотров: 516; Нарушение авторских прав

Мы поможем в написании ваших работ!