
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Межмолекулярные взаимодействия
Ранее рассматривались связи, обусловливающие образование молекул из атомов. Однако между молекулами также существует взаимодействие. Оно является причиной конденсации газов и превращения их в жидкие и твердые тела. Первую формулировку силам межмолекулярного взаимодействия дал в 1871 г. Ван-дер-Ваальс. Поэтому они получили название вандерваальсовых сил. Силы межмолекулярного взаимодействия можно подразделить на ориентационные, индукционные и дисперсионные.
Полярные молекулы вследствие электростатического взаимодействия разноименных концов диполей ориентируются с пространстве так, что отрицательные концы диполей одних молекул повернуты к положительным
концам диполей других молекул (ориентационное межмолекулярное взаимодействие). 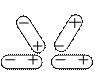
Энергия такого взаимодействия определяется электростатическим притяжением двух диполей. Чем больше диполь, тем сильнее межмолекулярное притяжение (Н2О, HCl).
Тепловое движение молекул препятствует взаимной ориентации молекул, поэтому с ростом температуры ориентационный эффект ослабевает. Индукционное взаимодействие наблюдается также и у веществ с полярными молекулами, но при этом оно обычно значительно слабее ориентационного.
Полярная молекула может увеличивать полярность соседней молекулы. Иными словами, под влиянием диполя одной молекулы может увеличиваться диполь другой молекулы, а неполярная молекула может стать полярной:
а
б 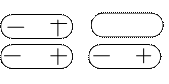
Дипольный момент, появляющийся в результате поляризации другой молекулой или ионом, называется индуцированным дипольным моментом, а само явление – индукцией. Таким образом, на ориентационное взаимодействие всегда должно накладываться индукционное взаимодействие молекул.

 В случае неполярных молекул (например, Н2, N2 или атомов благородных газов) ориентационное и индукционное взаимодействие отсутствует. Однако известно, что водород, азот и благородные газы сжигаются. Для объяснения этих фактов Лондон ввел понятие дисперсионных сил межмолекулярного взаимодействия. Эти силы взаимодействуют между любыми атомами и молекулами независимо от их строения. Они вызываются мгновенными дипольными моментами, согласованно возникающими в большой группе атомов:
В случае неполярных молекул (например, Н2, N2 или атомов благородных газов) ориентационное и индукционное взаимодействие отсутствует. Однако известно, что водород, азот и благородные газы сжигаются. Для объяснения этих фактов Лондон ввел понятие дисперсионных сил межмолекулярного взаимодействия. Эти силы взаимодействуют между любыми атомами и молекулами независимо от их строения. Они вызываются мгновенными дипольными моментами, согласованно возникающими в большой группе атомов:



 а + - + - б
а + - + - б
- + - +
В каждый данный момент времени направление диполей может быть иным. Однако их согласованное возникновение обеспечивает слабые силы взаимодействия, приводящие к образованию жидких и твердых тел. В частности, оно обусловливает переход благородных газов при низких температурах в жидкое состояние.
Таким образом, наименьшей составляющей среди сил, действующих между молекулами, является дисперсионное взаимодействие. Между молекулами с малой полярностью или не имеющими полярности (CH4, H2, HI) действующими силами являются в основном дисперсионные. Чем больше собственный дипольный момент молекул, тем больше ориентационные силы взаимодействия между ними.
В ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением размеров атомов, составляющих молекулы этих веществ. Например, в HCl на долю дисперсионных сил приходится 81% всего межмолекулярного взаимодействия, для НВr эта величина составляет 95%, а для HI – 99,5%.
| <== предыдущая страница | | | следующая страница ==> |
| Водородная связь | | | Описание химической связи в методе молекулярных орбиталей (МО) |
Дата добавления: 2014-04-24; просмотров: 375; Нарушение авторских прав

Мы поможем в написании ваших работ!