
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Предпосылки создания теории электролитической диссоциации. Изотонический коэффициент
Еще в конце XIX века было установлено, что для солей, кислот и щелочей реальное или наблюдаемое осмотическое давление, понижение давления пара, изменение температур кипения и замерзания всегда больше, чем это отвечает концентрации раствора. Так, например, для 0,2 н. раствора хлорида калия реальное понижение температуры замерзания в 1,81, то есть почти в два раза больше, чем вычисленное по формуле Рауля. (см. табл.1).
Табл. 1. Значение коэффициента i для 0,2 н. растворов некоторых солей
| Соль | Формула | Понижение температуры замерзания |
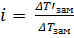
| |
| Наблюдаемое (ΔТ'зам) | Вычисленное по формуле Рауля (ΔТзам) | |||
| Хлорид калия | KCl | 0,673 | 0,372 | 1,81 |
| Нитрат калия | KNO3 | 0,664 | 0,372 | 1,78 |
| Хлорид магния | MgCl2 | 0,519 | 0,186 | 2,79 |
| Нитрат кальция | Ca(NO3)2 | 0,461 | 0,186 | 2,48 |
Когда для указанного раствора KCLизмерили повышение температуры кипения , эта величина также оказалась больше вычисленной по формуле 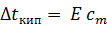 в такое же число раз.
в такое же число раз.
Во столько же число раз и осмотическое давление этого раствора оказалось больше теоретической величины.
Как Вы уже знаете, величина осмотического давления для разбавленных растворов подчиняется закону Вант-Гоффа: 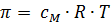 . Чтобы распространить этот закон на растворы с «ненормальным» осмотическим давлением, Вант-Гофф ввел в уравнение поправочный коэффициент, показывающий, во сколько раз осмотическое давление данного раствора больше нормального. Этот коэффициент был назван изотоническим и обозначался буквой i. Коэффициент i определялся для каждого раствора экспериментальным путем – например, по понижению давления пара, или по понижению температуры замерзания, или по повышению температуры кипения.
. Чтобы распространить этот закон на растворы с «ненормальным» осмотическим давлением, Вант-Гофф ввел в уравнение поправочный коэффициент, показывающий, во сколько раз осмотическое давление данного раствора больше нормального. Этот коэффициент был назван изотоническим и обозначался буквой i. Коэффициент i определялся для каждого раствора экспериментальным путем – например, по понижению давления пара, или по понижению температуры замерзания, или по повышению температуры кипения.
Оказалось, что для растворов солей наблюдаемые понижения давления пара, изменение температур кипения и замерзания, осмотическое давление всегда больше вычисленных по формулам в i раз:
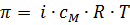 .
.
Δtкип = i  E
E  ,
,
Δtзам = i  K
K  ,
,
i – изотонический коэффициент или коэффициент Вант-Гоффа
Практически i определяют, сравнивая реально наблюдаемые и вычисленные по формулам значения Δtзам : i =  .
.
Вернемся к нашей таблице. В ней приведены значения изотонических коэффициентов, найденные Вант-Гоффом для двудецинормальных растворов некоторых солей. Из таблицы мы видим, что изотонический коэффициент i больше единицы и для разных солей имеет различные значения:
для 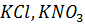 i
i 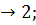 для
для 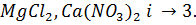
Итак, соли, кислоты, основания, растворяясь в воде, дают «увеличенные» по сравнению с теоретическими значения рассмотренных величин. Как это объяснить? Мы видим, что во все наши формулы входит произведение постоянных величин и обязательно входит концентрация раствора. А концентрация раствора, будь то молярная концентрация (как в формуле 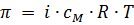 ), или моляльность (как в формуле Δtзам = i
), или моляльность (как в формуле Δtзам = i  K
K  ) обязательно зависит от числа частиц растворенного вещества в растворе. Поэтому естественно предположить, что в наших «ненормальных» растворах молекулы растворенных веществ распадаются на какие-то более мелкие частицы так, что общее число частиц в растворе возрастает. Впервые это предположение высказал шведский химик Сванте Аррениус в 1887 году.
) обязательно зависит от числа частиц растворенного вещества в растворе. Поэтому естественно предположить, что в наших «ненормальных» растворах молекулы растворенных веществ распадаются на какие-то более мелкие частицы так, что общее число частиц в растворе возрастает. Впервые это предположение высказал шведский химик Сванте Аррениус в 1887 году.
Так как и 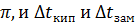 зависят от концентрации растворов, шведский химик Аррениус в 1887 году предположил, что молекулы солей, оснований и кислот при растворении распадаются на ионы, и общее число частиц в растворе увеличивается.
зависят от концентрации растворов, шведский химик Аррениус в 1887 году предположил, что молекулы солей, оснований и кислот при растворении распадаются на ионы, и общее число частиц в растворе увеличивается.
Следующий вопрос, который возникает при этом: на какие частицы распадаются соли, основания и кислоты? Когда Аррениус искал ответ на этот вопрос, уже было известно, что водные растворы солей, оснований и кислот обладают еще одной особенностью: они проводят электрический ток. При этом сухие соли, основания и кислоты тока не проводят, чистая вода сама по себе также обладает очень плохой проводимостью.
Как вы уже знаете из школьного курса, вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Электролиты – проводники II рода, электрический ток в них переносится ионами. Эти сведения были известны еще до Аррениуса, но считалось, что электролиты распадаются на ионы только под действием электрического тока. Аррениус же впервые обратил внимание на тесную связь между способностью растворов солей кислот и оснований проводить электрический ток и отклонениями свойств этих растворов от законов Рауля и Вант-Гоффа. Им была выдвинута гипотеза о том, что молекулы электролитов распадаются на ионы уже при растворении, еще до пропускания электрического тока.
Эти предположения в дальнейшем были развиты в стройную теорию, получившую название теории электролитической диссоциации (ТЭД).
Электролитическая диссоциация – это процесс распада электролита на ионы под действием полярных молекул растворителя.
Первое положение ТЭД
При растворении в воде электролиты распадаются на положительно заряженные ионы – катионы и отрицательно заряженные ионы – анионы.
Например, диссоциацию KCl и MgCl2 можно выразить уравнениями:
KCl = 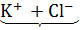 i
i  2;
2;
1 частица 2 иона
MgCl2 = 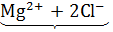 i
i  3;
3;
1 частица 3 иона
Вот теперь мы можем объяснить отклонения от законов Рауля и Вант-Гоффа. В качестве примера мы рассматривали понижение температуры замерзания для хлорида калия. Это понижение было в 1,81 раза больше рассчитанного по формуле Δtзам = K 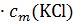 . Но теперь мы видим, что из одной условной молекулы
. Но теперь мы видим, что из одной условной молекулы 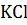 образуется вдвое большее число частиц, то есть концентрация частиц повышается вдвое. Поэтому и понижение температуры замерзания в растворе
образуется вдвое большее число частиц, то есть концентрация частиц повышается вдвое. Поэтому и понижение температуры замерзания в растворе 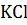 должно быть вдвое больше, чем в растворе неэлектролитов той же концентрации.
должно быть вдвое больше, чем в растворе неэлектролитов той же концентрации.
Точно также в разбавленном растворе хлорида магния понижение температуры замерзания оказывается в 2,79 раз больше, чем вычисленное по формуле Δtзам = K 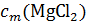 , так как число частиц в растворе
, так как число частиц в растворе 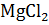 в три раза больше, чем если бы хлорид магния находился в растворе в виде условных молекул.
в три раза больше, чем если бы хлорид магния находился в растворе в виде условных молекул.
Рассмотренные примеры позволяют выяснить физический смысл изотонического коэффициента. Изотонический коэффициент i – это отношение всех частиц, находящихся в растворе, к числу частиц, введенных в раствор.
Однако, теория Аррениуса не сразу получила широкое признание. Особое недоумение вызывало у современников Аррениуса его предположение о диссоциации в растворе некоторых солей, например, хлорида натрия. Если хлорид натрия распадается в воде на натрий и хлор – говорили они – значит, раствор поваренной соли должен пахнуть хлором, а образовавшийся хлорид натрия должен бурно реагировать с водой. Почему этого не происходит? Ответом на этот вопрос служит второе положение теории электролитической диссоциации.
Второе положение ТЭД
Ионы по своим свойствам отличаются от атомов и молекул.
Однако, теория Аррениуса не учитывала всей сложности явлений в растворах. В частности, она рассматривала ионы как свободные, независимые от молекул растворителя частицы. Теории Аррениуса противостояла химическая или гидратная теория растворов Менделеева. Как вы помните, в основе этой теории лежит представление о взаимодействии растворенного вещества с растворителем. В преодолении кажущегося противоречия обеих теорий большая заслуга принадлежит русскому ученому И.А. Каблукову. Он впервые высказал предположение о гидратации ионов. Развитие этой идеи привело к дальнейшему объединению теории Аррениуса и Менделеева.
| <== предыдущая страница | | | следующая страница ==> |
| Тема № 4. Растворы. Дисперсные системы | | | Механизм диссоциации веществ с ионной связью |
Дата добавления: 2014-05-03; просмотров: 628; Нарушение авторских прав

Мы поможем в написании ваших работ!