
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Тема № 4. Растворы. Дисперсные системы
Жидкость замерзает тогда, когда давление пара над ней становится равным атмосферному. Для воды это происходит при 100 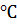 . Если же чистую воду и водный раствор (например, сахара) нагреть до 100
. Если же чистую воду и водный раствор (например, сахара) нагреть до 100 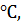 то вода закипит, а раствор - нет, так как согласно закону Рауля давление пара над раствором меньше, чем над чистым растворителем.
то вода закипит, а раствор - нет, так как согласно закону Рауля давление пара над раствором меньше, чем над чистым растворителем.
Чтобы раствор закипел, надо повысить давление пара над ним, то есть нагреть его до более высокой температуры. Следовательно, растворы кипят при более высокой температуре, чем чистый растворитель.
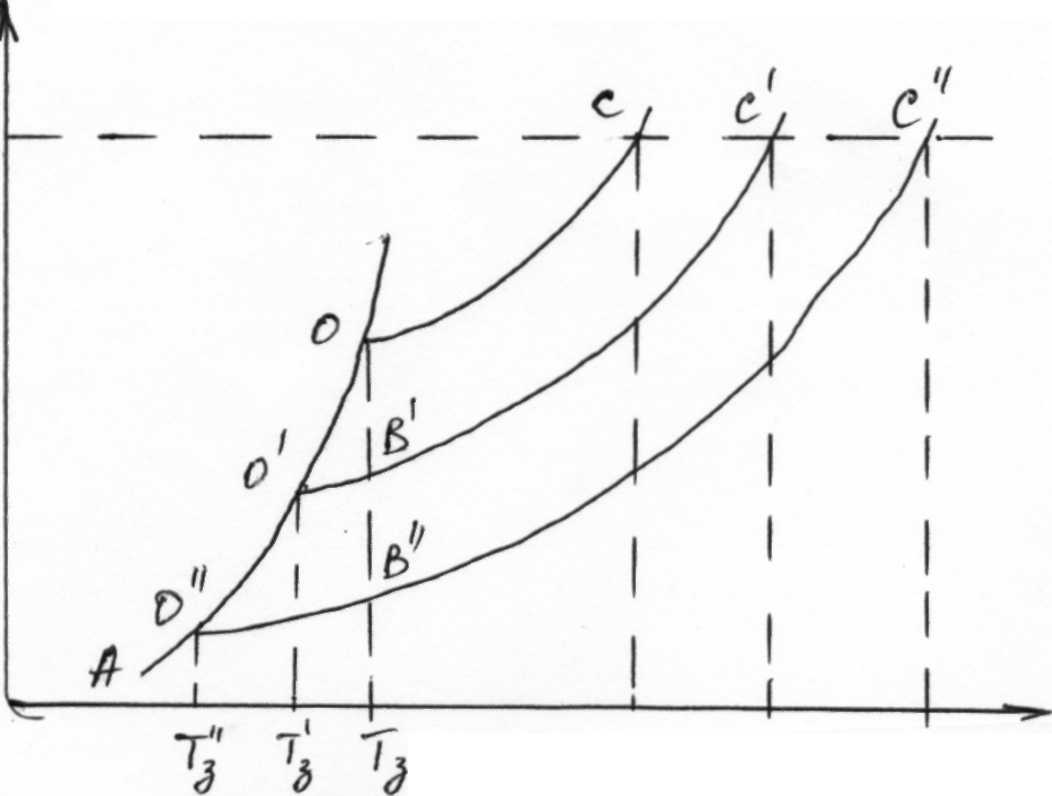
Установлено, что замерзают растворы, наоборот, при температуре более низкой, чем чистый растворитель (этот вывод можно сделать, анализируя диаграмму состояния раствора, приведенную на рис. 2)
Р
 Т
Т
Рис.2. Диаграмма состояния раствора.
Следствие из закона Рауля.
Повышение температуры кипения и понижения температуры замерзания прямо пропорционально моляльной концентрации раствора m:
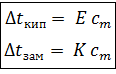 (1)
(1)
где  - (2)
- (2)
– моляльная концентрация растворенного вещества,
Е – эбулиоскопическая константа, К – криоскопическая константа.
Если 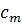 = 1 моль/1000 г р-ля,
= 1 моль/1000 г р-ля, 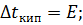
Эбулиоскопическая константа показывает, на сколько градусов выше, чем чистый растворитель, кипит одномоляльный раствор неэлектролита.
Если 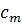 = 1 моль/1000 г р-ля,
= 1 моль/1000 г р-ля, 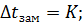
Криоскопическая константа показывает, на сколько градусов ниже, чем чистый растворитель, замерзает одномоляльный раствор неэлектролита.
E и K зависят от природы растворителя, но не зависят от природы растворенного вещества
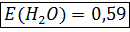
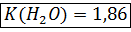 .
.
Подставим формулу (2) для моляльной концентрации в формулу (1) ⇒
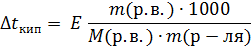
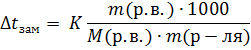
Определение молекулярной массы растворенного вещества по повышению температуры кипения раствора называется эбулиоскопией.
Определение молекулярной массы растворенного вещества по понижению температуры замерзания раствора называется криоскопией.
Задача 2. В радиатор автомобиля налили 8 л воды и 2 л этилового спирта ( 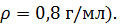 При какой наинизшей температуре можно после этого оставлять автомобиль на открытом воздухе?
При какой наинизшей температуре можно после этого оставлять автомобиль на открытом воздухе?
Решение.
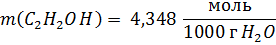
(см. зад.1).
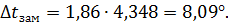
Вода замерзает при 0 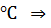 температура, при которой замерзнет раствор спирта, составит 0 – 8,09 = -8,09
температура, при которой замерзнет раствор спирта, составит 0 – 8,09 = -8,09 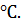
ЗАКЛЮЧЕНИЕ
Таким образом, растворы характеризуются как общими свойствами (которые иногда также называют коллигативными), так и свойствами, на которые влияет индивидуальная природа растворенных веществ. К общим свойствам относятся: осмотическое давление раствора, величина которого определяется по закону Вант-Гоффа; относительное понижение давления растворителя над раствором (закон Рауля); повышение температуры кипения и понижение температуры замерзания раствора (следствие из закона Рауля). Законы Рауля и Вант-Гоффа строго выполняются лишь для идеальных растворов, к которым приближаются разбавленные растворы.
Тема № 4. Растворы. Дисперсные системы
Занятие №3. Растворы электролитов
Текст лекции обсужден на заседании ПМК №__ кафедры «Химия» «___»____________ 2013 г., протокол №_____
г. Пенза
Содержание
Введение
1. Предпосылки создания теории электролитической диссоциации. Изотонический коэффициент.
2. Механизм электролитической диссоциации.
3. Степень электролитической диссоциации.
4. Слабые электролиты. Закон разбавления Оствальда.
5. Сильные электролиты. Активность электролитов.
6. Кислоты, основания и соли с точки зрения теории электролитической диссоциации.
7. Реакции ионного обмена.
Литература:
1. 1. Коровин Н. В. Общая химия. Учебник. – М.: Высшая школа, 1998. – с. 210 - 224.
Учебно – материальное обеспечение:
1. Мультимедийный проектор.
2. Установка для испытания электропроводности растворов; растворы электролитов и неэлектролитов.
Цель занятия:
Знать: 1.Теория электролитической диссоциации. Особенности применения законов идеальных растворов к растворам электролитов. Изотонический коэффициент.
2. Степень диссоциации. Уравнение связи между изотоническим коэф-фициентом и степенью диссоциации. Сильные и слабые электролиты. Константа диссоциации. Уравнение связи между константой диссоциации и степенью диссоциации – закон разбавления Оствальда.
3. Ступенчатая диссоциация многоосновных кислот и многокислотных гидроксидов в растворе. Диссоциация амфотерных электролитов.
4. Смещение равновесия реакций обмена для электролитов. Примеры реакций.
Ознакомиться: с буферными растворами.
Организационно-методические указания:
1.Проверить наличие обучаемых и их готовность к занятиям, устранить недостатки.
2.Объявить тему и цель занятия, учебные вопросы, литературу.
3.Обосновать необходимость изучения данной темы на примерах применения электролитов в приборостроении.
4.Рассмотреть учебные вопросы с применением кадров презентации и установки для испытания электропроводности растворов.
5.По каждому учебному вопросу и в конце занятия подвести итоги.
6.В конце занятия выдать задание на самоподготовку.
ВВЕДЕНИЕ
На предыдущей лекции мы познакомились с общими (коллигативными) свойствами растворов, изучили основные закономерности, описывающие поведение этих растворов. Справедливость этих закономерностей подтверждается результатами многих экспериментов. Однако, имеются вещества, растворы которых сильно отклоняются от всех рассмотренных законов. К подобным веществам относятся соли, кислоты и щелочи. Изучению этих веществ, получивших название электролитов, и посвящена настоящая лекция.
| <== предыдущая страница | | | следующая страница ==> |
| Замерзание и кипение растворов. Следствие из закона Рауля | | | Предпосылки создания теории электролитической диссоциации. Изотонический коэффициент |
Дата добавления: 2014-05-03; просмотров: 342; Нарушение авторских прав

Мы поможем в написании ваших работ!