
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Определение цинка, кадмия, свинца и меди при их совместном присутствии методом инверсионной вольтамперометрии
В различных видах пищевой продукции или продукции промышленного назначения могут присутствовать ксенобиотики, поступающее в нее в результате миграции из загрязненного сырья, а также при нарушении технологической обработки или условий хранения готовой продукции.
Загрязнителями токсического действия являются: токсичные элементы (ртуть, свинец, кадмий, мышьяк, цинк, медь, олово, железо), микотоксины, пестициды, нитраты, нитриты. Из токсичных элементов значительную опасность представляют собой свинец и кадмий.
Характеристика свинца как токсичного элемента приведена в п. 7.1.
Кадмий – токсичный элемент, содержание которого в различных группах продукции нормируется в [33]. Естественный уровень кадмия в пищевых продуктах примерно в 5–10 раз ниже, чем свинца. Повышенные его концентрации наблюдаются в какао-порошке (до 0,5 мг/кг), почках животных (до 1 мг/кг) и рыбе (до 0,2 мг/кг). Содержание кадмия увеличивается в консервах из сборной жестяной тары, поскольку он, как и свинец, содержится в припое.
В промышленной продукции кадмий, как и свинец, может содержаться в высоких дозах ввиду их миграции из сырья, при использовании различных красителей, в состав которых входят данные токсичные элементы, а также при нарушении технологических режимов производства.
Медь и цинк с одной стороны относятся к необходимым для организма человека микроэлементам, а с другой, при их избыточной миграции из технологического оборудования или используемых полуфабрикатов, могут повлиять на безопасность продукта.
Например, причинами избыточного содержания меди в организме может быть ее избыточное поступление (вдыхание паров и пыли соединений меди в условиях производства, бытовые интоксикации растворами соединений меди, использование медной посуды), а также нарушения регуляции обмена. Избыток меди в организме может сопровождаться ухудшением памяти, депрессией, бессонницей.
Содержание всех указанных токсичных элементов нормируется в [33] в зависимости от вида и/или группы продукции, а также степени ее опасности.
1 Метод измерений
Метод основан на регистрации и анализе вольтамперограммы после накопления цинка, кадмия, свинца и меди на поверхности электрода из стеклоуглерода.
2 Средства измерений
Анализатор вольтамперометрический АВА-1, сопряженный с компьютером;
Весы лабораторные 2-го класса точности с наибольшим пределом взвешивания 210 г;
Дозаторы пипеточные с переменным объемом – 0,01–1,0 см3;
Колбы мерные вместимостью 100, 500 и 1000 см3;
Пипетки вместимостью 0,1, 1,0, 2,0, 5,0 и 10,0 см3;
Цилиндр мерный вместимостью 25 см3;
Электрохимическая ячейка, включающая индикаторный электрод (стеклоуглеродный), электрод сравнения (хлоридсеребряный) и вспомогательный электрод (платиновый).
3 Вспомогательные материалы
Стакан химический вместимостью 50 см3.
4 Материалы, реактивы и растворы
Вода дистиллированная;
Калия нитрат (KNO3), раствор – 0,1 моль/дм3;
Кадмия (Cd2+) раствор – 1 г/дм3 (стандартный раствор). 0,2281г CdSO4× 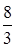 H2O, количественно переносят в мерную колбу (100 см3) добавляют 0,5 см3 концентрированной серной кислоты и приблизительно 30 см3 биддистиллированной воды, растворяют и доводят до метки водой;
H2O, количественно переносят в мерную колбу (100 см3) добавляют 0,5 см3 концентрированной серной кислоты и приблизительно 30 см3 биддистиллированной воды, растворяют и доводят до метки водой;
Кислота азотная (HNО3), концентрированная;
Кислота серная (H2SО4), концентрированная;
Кислота фосфорная (H3РО4), раствор – 0,1 моль/дм3;
Меди (Cu2+) раствор – 1 г/дм3 (стандартный раствор). 0,3929 г CuSO4× 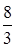 H2O количественно переносят в мерную колбу (100 см3) добавляют 1 см3 серной кислоты и приблизительно 30 см3 бидистиллированной воды, растворяют и доводят до метки водой;
H2O количественно переносят в мерную колбу (100 см3) добавляют 1 см3 серной кислоты и приблизительно 30 см3 бидистиллированной воды, растворяют и доводят до метки водой;
Ртути нитрат (Hg(NO3)2), раствор – 10 г/дм3. В мерную колбу (500 см3) вносят 10 см3 раствора азотной кислоты (2:3) и 8,35 г нитрата ртути (II). После растворения соли раствор разбавляют бидистиллированной водой до метки.
Ртути нитрат (Hg(NO3)2), раствор – 1 г/дм3. Готовят разбавлением раствора 10 г/дм3 бидистиллированной водой в 10 раз.
Раствор вводят в анализируемый раствор непосредственно перед проведением измерений: по 2 капли на 20 см3 анализируемого раствора.
Свинца (Pb2+) раствор – 1 г/дм3 (стандартный раствор). 0,1600 г Pb(NO3)2 количественно переносят в мерную колбу (100 см3) добавляют 1 см3 азотной кислоты и приблизительно 30 см3 биддистиллированной воды, растворяют и доводят до метки водой;
Цинка (Zn2+) раствор – 1 г/дм3 (стандартный раствор). ?????. г Zn(NO3)2×7Н2О количественно переносят в мерную колбу (100 см3) добавляют 0,5 см3 азотной кислоты и приблизительно 30 см3 бидистиллированной воды, растворяют и доводят до метки водой;
Кадмия (Cd2+), меди (Cu2+), свинца (Pb2+) и цинка (Zn2+) растворы – 0,1 г/дм3 (рабочие растворы). Готовят путем десятикратного разведения исходного раствора (1 г/дм3): в мерную колбу вместимостью 50 см3 вносят пипеткой 5 см3 стандартного раствора и доводят до метки бидистиллированной водой.
ионов кадмия (Cd2+), меди (Cu2+), свинца (Pb2+) и цинка (Zn2+) растворы – 2 мг/дм3 (контрольные растворы). Готовят разбавлением рабочих растворов (0,1 г/дм3) бидистиллированной водой: в мерную колбу вместимостью 100 см3 вносят пипеткой 2 см3 рабочего раствора и доводят до метки бидистиллированной водой.
5 Подготовка к выполнению измерений
5.1 Подготовка средств измерений
Анализатор АВА-1 готовят к измерениям согласно инструкции по эксплуатации (Приложение Д).
5.2 Приготовление фонового электролита
В мерной колбе вместимостью 1 дм3 растворяют 10,11 г нитрата калия, пипеткой вносят 10 см3 0,1 моль/дм3 фосфорной кислоты. Раствор разбавить бидистиллированной водой до метки Полученный фоновый раствор имеет состав 0,1 моль/дм3 KNO3, 0,001 моль/дм3 H3РО4.
5.3 Приготовление стандартного раствора смеси металлов
В мерной колбе объемом 100 см3 готовят раствор, содержащий по 2 мг/дм3 ионов Cd2+, Cu2+, Pb2+, Zn2+. Для этого в мерную колбу с помощью пипет-дозатора вводят по 0,2 см3 соответствующих стандартных растворов (1 г/дм3). Разбавление до метки проводят фоновым электролитом и перемешивают.
5.4 Подготовка проб
Взвешивают 50 г пробы с точностью до 0,01 г.
Подготовка пробы осуществляется методами сухого или мокрого разложения как указано в лабораторных работах №№ 1 и 2 соответственно.
Золу, полученную после минерализации, растворяют в растворе азотной кислоты (2:3) на водяной бане. Выпаривают раствор до влажных солей. Для удаления паров кислоты добавляют к остатку 10 см3 бидистиллированной воды и упаривают до влажных солей (повторяют дважды), охлаждают до комнатной температуры. К полученному остатку добавляют 10 см3 фонового электролита, растворяют пробу и количественно переносят в мерную колбу объемом 25 см3. Раствор доводят до метки фоновым электролитом.
Параллельно готовят контрольную пробу на бидистиллированной воде.
6 Порядок выполнения измерений
Процедура измерений включает следующие этапы:
– установка условий измерений;
– регистрация вольтамперных кривых: фона, пробы, пробы с добавкой;
– анализ контрольной пробы.
6.1 Условия измерений для определения свинца
1 стадия – регенерация индикаторного электрода: E = + 350 мВ, τ = 20 сек (для стеклоуглеродного электрода);
2 стадия – накопление определяемого металла. E = (– 1200)– (–1300) мВ, τ = 60–80 сек;
3 стадия – успокоение раствора. E = (– 1200)– (–1300) мВ, τ = 20 сек;
4 стадия – измерительная. Скорость развертки потенциала – 200 мВ/сек.
6.3 Регистрация вольтамперной кривой фона
Выполняют операции по пп. 8–13 в соответствии с Приложением Е.
6.4Регистрация вольтамперной кривой пробы
Выполняют операции по пп. 14–20 в соответствии с Приложением Е.
6.5 Регистрация вольтамперной кривой пробы с добавкой
Выполняют операции по пп. 21–26 в соответствии с Приложением Е.
В качестве добавки вносят 0,2 см3 стандартного раствора смеси ионов металлов.
6.6 Анализ контрольной пробы
Выполняют операции по пп. 21–26 в соответствии с Приложением Е.
7 Обработка и вычисление результатов измерений
Обработку результатов измерений каждой параллельной пробы анализируемой и контрольной проб, а также расчет концентрации аналитов в пробе выполняет система сбора и обработки данных анализатора.
Выполняют операции по пп. 32–33 в соответствии с Приложением Е.
По запросу программы вводят следующие данные:
– объем ячейки – 20 см3;
– объем добавки – 0,2 см3;
– концентрация Cd2+, Cu2+, Pb2+, Zn2+ в добавке – 2000 мкг/дм3;
– масса навески – 50±0,05 г;
– объем пробы – 25 см3.
Абсолютная погрешность измерения при вероятности P = 0,95 не превышает для Cd – 47, Cu – 39, Pb – 49 и Zn – 42%.
8 Индивидуальное задание
Определить содержание цинка, кадмия, свинца и меди при их совместном присутствии в:
1) заданном растворе;
2) муке;
3) яблоках;
4) йогурте;
5) зубном порошке;
6) бумаге;
7) фольге;
8) игрушках для детей
и сравнить полученное значение с установленным нормативом [33].
7.3 Лабораторная работа № 3 Определение меди методом потенциометрии
Медь является одним из металлов, известных с древнейших времен, и в настоящее время занимает второе место (после алюминия) по объему промышленного производства. Медь применяется для изготовления кабелей, токопроводящих частей электрических установок, теплообменников. Она является основным компонентом латуней, бронз, медно-никелевых и других сплавов, обладающих высокими антифрикционными свойствами, сочетающимися с хорошей коррозионной стойкостью на воздухе. Эти сплавы характеризуются, кроме того, хорошей электрической проводимостью, пластичностью и достаточно высокой прочностью. Медные катализаторы применяются в некоторых органических синтезах (гидрирование жирных кислот, окисление пропилена в акролеин и т.д.). Физические и химические свойства меди зависят от степени ее чистоты. Примеси меди в продуктах различных производств также влияют на свойства этих материалов.
Для организма человека медь является жизненно важным микроэлементом, играющим значительную роль в регуляции окислительно-восстановительных процессов и кроветворения, формировании соединительной ткани. Участвует в синтезе гемоглобина и производстве эритроцитов, жизненно необходима для нормального развития костей, соединительных тканей, целостности сердечно-сосудистой системы, формирует эластин, необходима для иммунной системы и центральной нервной системы, играет важную роль в выработке миелина. К симптомам недостаточности меди относят: анемии, снижение иммунитета, низкое содержание лейкоцитов, нарушение формирования коллагена, деминарилизация костей, выпадение волос, пигментация кожи.
К природным источникам меди относятся шоколад, печенка, орехи, грибы, моллюски, лосось, шпинат. Суточная потребность в меди – 1,5–2 мг. При злоупотреблении алкоголем, хронических заболеваниях, анемии, воспалении, снижении иммунитета потребность в меди возрастает.
Хотя медь и не является токсичным элементом, присутствие ее в природных, сточных, водопроводных и котловых водах, а также в некоторых промышленных и пищевых продуктах регламентируется гигиеническими требованиями [33].
1 Метод измерений
Сущность метода заключается в измерении потенциала медьселективного электрода, погруженного в анализируемый раствор (раствор пробы или ее золы в фоновом электролите) и определении концентрации меди по градуировочному графику.
2 Средства измерений
Иономер И–130 М;
Колбы мерные вместимостью 50, 250 и 500 см3;
Пипетки вместимостью 5,0 см3;
Стаканчик для взвешивания вместимостью 50,0 см3;
Электрохимическая ячейка, включающая индикаторный (медьселективный) электрод, хлоридсеребряный электрод сравнения.
3 Вспомогательные материалы
Бумага масштабная координатная;
Мешалка магнитная;
Стакан химический вместимостью 100 см3.
4 Материалы, реактивы и растворы
Вода дистиллированная;
Калия нитрат (KNO3), раствор – 0,1 моль/дм3 (фоновый электролит);
Кислота азотная (KNO3), концентрированная;
Меди сульфат (CuSO4), раствор – 0,1 моль/дм3.
5 Подготовка к выполнению измерений
5.1 Подготовка средств измерений
Иономер и электроды готовят к измерениям согласно инструкциям по эксплуатации (Приложение Е).
5.2 Приготовление градуировочныхрастворов
Стандартные раствора с концентрацией ионов меди – 1∙10-2, 5∙10-3, 1∙10-3, 5∙10-4, 1∙10-4 моль/дм3– готовят в мерных колбах вместимостью 50 см3 из основного раствора сульфата меди (0,1 моль/дм3) путем последовательного разбавления фоновым электролитом (0,1 моль/дм3 раствор нитрата калия).
5.3 Подготовка проб
Взвешивают 50 г пробы с точностью до 0,01 г.
Подготовка пробы осуществляется методами сухого или мокрого разложения как указано в лабораторных работах №№ 1 и 2 соответственно.
Золу, полученную после минерализации, растворяют в растворе азотной кислоты (2:3) на водяной бане. Выпаривают раствор до влажных солей. Для удаления паров кислоты добавляют к остатку 10 см3 дистиллированной воды и упаривают до влажных солей (повторяют дважды), охлаждают до комнатной температуры. К полученному остатку добавляют 10 см3 фонового электролита, растворяют пробу и количественно переносят в мерную колбу объемом 50 см3. Раствор доводят до метки фоновым электролитом.
6 Порядок выполнения измерений
6.1 Постороение градуировочного графика
Приготовленные по п. 5.2 градуировочные растворы переносят в стакан, куда опускают якорь магнитной мешалки, электродную пару (электрод ионоселективный и электрод сравнения) и после установления постоянного значения измеряют величину потенциала.
Измерения начинают с раствора с наименьшей концентрацией и последовательно переходят к более концентрированным растворам.
Измерение потенциалов в каждом растворе проводят дважды и находят среднее значение
Полученные данные используют для построения градуировочногографика в координатах Е = f (pС), где Е – измеренное значение потенциала в градуировочном растворе и рС = - lg C (С – концентрация меди в градуировочном растворе, моль/дм3).
График строят на бумаге масштабной координатной или с использованием персонального компьютера.
6.2 Измерение потенциала в анализируемом растворе
Полученный по п. 5.3 анализируемый раствор переносят в стакан, куда опускают якорь магнитной мешалки, электродную пару и измеряют величину потенциала.
Проводят анализ двух параллельных проб.
7 Обработка и вычисление результатов измерений
7.1 Расчет концентрации меди в анализируемом растворе
Концентрацию меди в анализируемом растворе (С, моль/дм3) определяют по формуле:
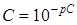 ,
,
где рС = – lg C и определяют по градуировочному графику (п. 6.1).
7.2 Расчет концентрации меди в анализируемой пробе
Содержание меди в исследуемом образце (x, мг/кг) рассчитывают по формуле:
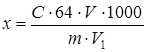 ,
,
где С – концентрация меди в анализируемом растворе, моль/дм3 (п. 7.1); 64 – молярная масса меди, г/моль; V – общий объем раствора, полученного после подготовки пробы, см3; 1000 – коэффициент пересчета с массы пробы на 1000 г продукта; m – масса пробы, г; V1 – объем раствора, взятый для анализа, см3.
Результаты вычислений округляют до трех значащих цифр после запятой. За окончательный результат измерения принимают среднее арифметическое результатов двух параллельных определений. Окончательный результат округляют до второго знака после запятой.
8 Индивидуальное задание
Определить содержание меди в:
1) воде питьевой;
2) шоколаде;
3) моркови;
4) сыре;
5) зубном порошке;
6) бумаге;
7) фольге;
8) игрушках для детей
и сравнить полученное значение с установленным нормативом [33].
7.4 Лабораторная работа № 4
| <== предыдущая страница | | | следующая страница ==> |
| Определение свинца методом инверсионной вольтамперометрии | | | Определение нитратов в растительном сырье и продуктах его переработки методом потенциометрии |
Дата добавления: 2014-07-19; просмотров: 427; Нарушение авторских прав

Мы поможем в написании ваших работ!