
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Строение атома углерода и типы его гибридизации
План
1. Строение атома углерода: основное и возбуждённое состояние, валентность
2. Типы гибридизации, образование сигма- и пи-связи
3. Характеристика связи и химическая активность соединений
Литература
1. А.И. Артеменко. Органическая химия.– М.: Высшая школа, 2000.– 410 с.
2. В.Н. Заплишный. Органическая химия. Краснодар, 1999
3. В.Г. Иванов, В.А. Горленко, О.М. Гева. Органическая химия.– М.: Академия, 2008.– 520 с
4. И.И. Грандберг. Органическая химия. М.: 2001 - 672 с.
5. В.Г. Жиряков. Органическая химия. – М.: Химия, 1978.-408 с.
6. http://www.alhimik.ru/ - информационный сайт по химии
7. http://www.hemi.nsu.ru/ - основы химии (Интернет-учебник)
1 ВОПРОССтроение атома углерода: основное и возбуждённое состояние, валентность
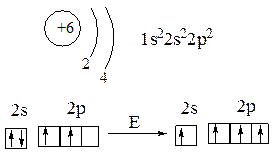 Углерод — химический элемент четвёртой группы главной подгруппы второго периода периодической системы Д.И.Менделеева с порядковым номером 6:
Углерод — химический элемент четвёртой группы главной подгруппы второго периода периодической системы Д.И.Менделеева с порядковым номером 6:
основное возбуждённое
состояние состояние
Под действием энергии извне происходит распаривание 2s-электронов с образованием конфигурации 2s12p3 (возбуждённое состояние), которая имеет четыре неспаренных электрона, что объясняет четырёхвалентное состояние атома углерода в органических соединениях.
2 ВОПРОС Типы гибридизации, образование и характеристика сигма- и пи-связи
Гибридизация – выравнивание или смешивание s- и р-орбиталей с образованием новых атомных орбиталей видоизменённой формы, называемых гибридными орбиталями.
Атом углерода характеризуется тремя видами гибридизации с участием s- и p-орбиталей.
sр3-гибридизация. Гибридизуются одна s- и три р-орбитали атома углерода:
1s + 3р → 4sр3 гибридные орбитали
(тетраэдр)
Гибридные орбитали образуют одинарные σ-связи (сигма-связи), угол между которыми составляет 109º28'.
σ-связь - ковалентная связь между атомами, образованная при прямом перекрывании их гибридных электронных облаков.
 Данный тип гибридизации характерен для алканов, простейшим представителем которых является метан:
Данный тип гибридизации характерен для алканов, простейшим представителем которых является метан:
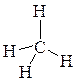
одна область
σ-перекрывания
или
sр2-гибридизация.Гибридизуются одна s- и две р-орбитали:
1s + 2р → 3sр2 гибридные орбитали
(тригональная)
Негибридные орбитали атомов углерода располагаются перпендикулярно плоскости sр2-гибридных орбиталей и, перекрываясь, образуют π-связь (пи-связь):
π-связь - ковалентная связь между атомами, образованная при боковом перекрывании негибридных электронных облаков.
Данный вид гибридизации характерен для соединений с двойной связью. Образование σ- и π- связей в молекуле этилена:

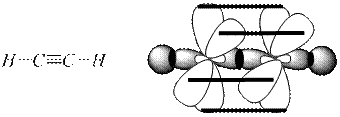
sр-гибридизация
1s + 1р → 2sр гибридные орбитали
(линейная)
Две негибридные р-орбитали участвуют в образовании двух π-связей.
Данный вид гибридизации характерен для алкинов (ацетилен):
3 ВОПРОС Характеристика связей и химическая активность соединений
Двойные и тройные или кратные химические связи называют ненасыщенными. В ходе некоторой реакции атомы углерода, несущие кратные связи, способны переходить в sp3-гибридное состояние, образуя насыщенные сигма-связи, которые могут только разрываться с образованием новых связей. Следовательно, наиболее прочной является σ-связь, значение энергии разрыва связи которой составляет около 340 кДж/моль, затем идёт пи-связь в sp2-гибридном состоянии (около 270 кДж/моль) и наименее прочна π-связь в sp-гибридном состоянии (около 245 кДж/моль).
Действительно, в химическом отношении алканы не активны: в специальных условиях вступают в некоторые реакции замещения, окисления, крекинга. Энергия π-связи в алкенах меньше энергии σ-связи примерно на 70 кДж/моль, что способствует протеканию реакции присоединения. Энергия тройной связи в молекуле алкина меньше, чем энергия двойной связи в молекуле алкена на 30 кДж/моль, поэтому алкины являются весьма реакционноспособными веществами.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности видоизменения атомных орбиталей при образовании ковалентной химической связи.
| <== предыдущая страница | | | следующая страница ==> |
| Скелет нижних конечностей | | | ОБУЧАЕМОСТЬ И ЕЕ КРИТЕРИИ. УСВОЕНИЕ В УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ |
Дата добавления: 2014-08-09; просмотров: 3980; Нарушение авторских прав

Мы поможем в написании ваших работ!