
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ВЫПАРНЫЕ АППАРАТЫ И УСТАНОВКИ
2.1. Свойства растворов
Концентрацией или составом раствора в технике принято называть массовое количество растворенных твердых веществ в определенном массовом или объемном количестве раствора или растворителя (воды). Процентную концентрацию bможно выразить через количество сухого вещества 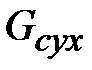 и растворителя
и растворителя 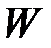 , кг в следующем виде:
, кг в следующем виде:
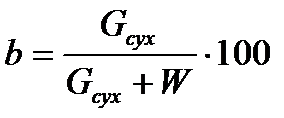 , %
, %
или (2.1) 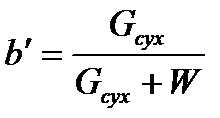 .
.
В определенном количестве воды или другого растворителя нельзя растворить любое количество твердого вещества. Раствор, содержащий предельное количество растворенного вещества, называется насыщенным.
Количество растворенного вещества в насыщенном растворе, отнесенное к определенному количеству раствора или растворителя, называется растворимостью. Растворимость твердых веществ в воде не является постоянной величиной, а изменяется в значительных пределах в зависимости от температуры. Кривые растворимости некоторых солей в зависимости от температуры показаны на рис. 2.1. Изменение давления практически не влияет на растворимость солей в воде.

Рис. 2.1. Растворимость некоторых солей в зависимости от температуры
Температура кипения растворов
Давление пара растворителя над раствором всегда ниже, чем давление над чистым растворителем. Температура кипения раствора выше температуры кипения чистого растворителя при том же давлении. Например, вода кипит при атмосферном давлении при 100 °С, так как давление ее насыщенных паров при этой температуре составляет 0,1 МПа, 70 %-й раствор аммиачной селитры NH4NO3 при том же атмосферном давлении закипит при температуре 120 °С. Однако, образующиеся из этого раствора водяные пары будут иметь ту же температуру, что и в случае кипения чистой воды, т.е. около 100 °С.
Разность между температурами кипения раствора tр и чистого растворителя 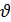 называется температурной депрессией:
называется температурной депрессией:
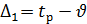 , К.
, К.
Температурная депрессия зависит от свойств растворенного вещества и растворителя; она повышается с увеличением концентрации раствора и давления.
Определяется температурная депрессия опытным путем. Справочные данные обычно относят к температурной депрессии при атмосферном давлении.
Если известна температурная депрессия при атмосферном давлении 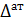 , можно найти депрессию при других давлениях по приближенной формуле И.А. Тищенко:
, можно найти депрессию при других давлениях по приближенной формуле И.А. Тищенко:
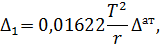
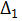 – температурная депрессия при давлении выпаривания, К;
– температурная депрессия при давлении выпаривания, К;
T – абсолютная температура кипения раствора при данном давлении, К;
r – скрытая теплота парообразования для растворителя при давлении выпаривания, кДж/кг.
Обычно величину 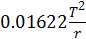 обозначают через
обозначают через 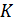 :
:
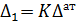 .
.
Повышение температуры раствора определяется не только температурной депрессией, но также гидростатической и гидравлической депрессиями.
Гидростатической депрессией 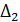
называется разность между температурами кипения нижних и верхних слоев раствора в выпарном аппарате, обусловленная гидростатическим давлением верхних слоев.
Если, например, нагревать при атмосферном давлении воду до температуры кипения в трубе высотой 10 м, то верхний слой воды закипит при температуре 100 °С, а нижний слой, находящийся под давлением 0,2 МПа – при температуре 120 °С. В данном случае гидростатическая депрессия изменяется по высоте трубы от 0 °С (наверху) до 20 °С (внизу) и в среднем составляет около 10 °С.
Расчет гидростатической депрессии в выпарных аппаратах невозможен, так как жидкость в них непрерывно перемещается. С повышением уровня жидкости в аппарате гидростатическая депрессия возрастает. В среднем она составляет 1–3 °С.
Гидравлической депрессией 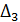
называется снижение температуры, связанное с потерей давления на трение и местные потери в трубопроводах, соединяющих корпуса выпарной установки; в практических расчетах ее принимают равной 1 °С для каждого корпуса.
Температура кипения раствора t определяется в зависимости от температуры насыщения вторичного пара 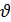 по формуле
по формуле

где
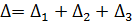 .
.
Для определения температуры кипения раствора при различных давлениях в формуле (2.2) можно использовать эмпирический закон Бабо, по которому отношение давления насыщения пара 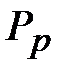 на раствором к давлению насыщения пара чистой воды
на раствором к давлению насыщения пара чистой воды 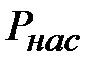 при той же температуре есть величина постоянная, для данной концентрации не зависящая от температуры кипения, т.е.
при той же температуре есть величина постоянная, для данной концентрации не зависящая от температуры кипения, т.е.
 . (2.4)
. (2.4)
Таким образом, если температура кипения раствора данной концентрации при атмосферном давлении известна, то вычислить температуру кипения его при любом другом давлении весьма просто.

Рис. 2.2. Температурная депрессия
в зависимости от концентрации раствора при кипении
1- 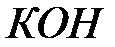 ; 2-
; 2- 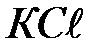 ; 3-
; 3-  ; 4-
; 4- 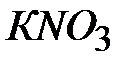 ; 5-
; 5- 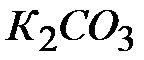 ; 6-
; 6- 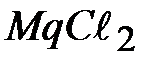 ; 7-
; 7- 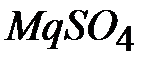 ;
;
8- 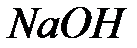 ; 9-
; 9- 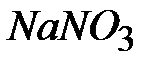 ; 10-
; 10- 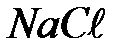 ; 11-
; 11- 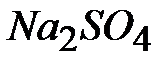 ; 12-
; 12- 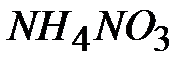 ; 13-
; 13- 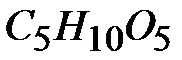 ;
;
14- 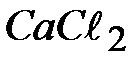 ; 15-
; 15- 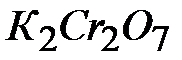
Следует иметь в виду, что закон Бабо дает достаточно точные результаты для слабо концентрированных растворов.
Плотность раствора можно легко определить по правилу аддитивности, зная его концентрацию и плотности чистых компонентов при данной температуре
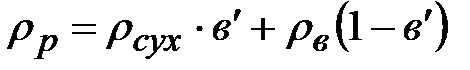 , кг/м3, (2.5)
, кг/м3, (2.5)
где 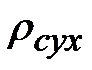 - плотность безводного нелетучего вещества, кг/м;
- плотность безводного нелетучего вещества, кг/м;
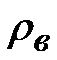 - плотность растворителя (воды), кг/м;
- плотность растворителя (воды), кг/м;
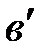 - долевое содержание вещества в растворе.
- долевое содержание вещества в растворе.
Плотности растворов некоторых веществ в зависимости от концентрации приведены в табл. 2.1.
Вязкость всех растворов находится в большой зависимости от температуры, уменьшаясь с ее повышением. Динамическая вязкость некоторых водных растворов приведена в табл. 2.2. Изменение относительной вязкости в зависимости от концентрации для некоторых растворов приведено на рис. 2.3.

Рис. 2.3. Относительная вязкость раствора
в зависимости от его концентрации
Теплоемкость раствора 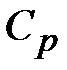 приближенно можно определить также по правилу аддитивности:
приближенно можно определить также по правилу аддитивности:
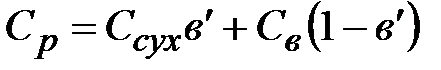 , кДж/(кг×К), (2.6)
, кДж/(кг×К), (2.6)
где 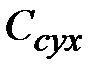 - теплоемкость безводного нелетучего вещества в растворе, кДж/(кг×К);
- теплоемкость безводного нелетучего вещества в растворе, кДж/(кг×К);
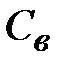 = 4,186 кДж/(кг×К) – теплоемкость воды при 20 оС.
= 4,186 кДж/(кг×К) – теплоемкость воды при 20 оС.
Теплоемкость некоторых веществ приведена в табл. 2.3.
Теплоемкость раствора зависит не только от концентрации растворения вещества, но и от температуры. Принцип аддитивности не всегда применим для растворов с большой концентрацией. В этом случае лучше пользоваться графическими зависимостями (рис. 2.4).
| <== предыдущая страница | | | следующая страница ==> |
| ПРОЦЕСС ВЫПАРИВАНИЯ | | | Лекция №6 ГЕНЕТИКА ЧЕЛОВЕКА |
Дата добавления: 2014-08-09; просмотров: 618; Нарушение авторских прав

Мы поможем в написании ваших работ!