
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры, катализатора, излучения и т. д
Зависимость скорости реакции от концентрации выражается законом действующих масс:
Скорость химической реакции прямо пропорциональна концентрации реагирующих веществ в степени их стехиометрических коэффициентов.
Для химической реакции
mA+nB=D
V=K[A]m[B]n (основное кинетическое уравнение)
Где [A] и [B] – концентрация веществ
m и n – стехиометрические коэффициенты
К – константа скорости.
Зависимость скорости химической реакции от температуры определяется правилом Вант – Гоффа, которое гласит:
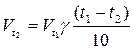 При повышении температуры на 100С скорость реакции возрастает в 2-4 раза.
При повышении температуры на 100С скорость реакции возрастает в 2-4 раза.
Vt1 – скорость химической реакции до изменения температур
Vt2 - скорость химической реакции после изменения температур
t1 t2 – температура
- 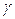 температурный коэффициент.
температурный коэффициент.
В зависимости от природы реагентов и условий протекания химического процесса различают:
необратимые
KClO3®KCl+O2↑
и обратимые реакции
NH4Cl↔NH3+HCl
В обратимых реакциях наступает момент, когда скорость прямой реакции становится равна скорости обратной реакции, то есть
K1[NH4Cl]=K2[NH3][HCl] такое состояние системы называют химическим равновесием.
При постоянной температуре отношения скоростей прямой и обратной реакции представляют собой постоянную величину, называемую константой равновесия.
Для обратимой реакции при данной температуре, отношение произведения равновесных концентраций продуктов реакций к произведению концентраций исходных веществ, возведенных в степень их стехиометрических коэффициентов, есть величина постоянная, называемая константой равновесия.
Для реакции аА+вВ«сС+дД
 | |||
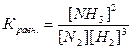 |
N2+3H2®2NH3
[NH3], [N2], [H2] – равновесные концентрации
7.2.При изменении внешних условий (температуры, давления, концентрации) нарушается равновесие, называемое смещением или сдвигом равновесия.
Направление, в котором происходит смещение, определяется принципом Ле – Шателье.
Изменение внешних условий вызывает смещение равновесия в направлении реакции, противодействующей произведенному измерению.
Если на систему, находящуюся в равновесии производится внешнее воздействие (изменение С, Т, Р), то в системе развиваются процессы, уменьшающие внешние воздействия.
| Внешнее воздействие | Увеличение концентрации | Увеличение температуры | Увеличение давления |
| Смещение равновесия | В сторону уменьшения концентрации | В сторону эндотерми-ческой реакции | В сторону образования меньшего количества молекул |
Пример:
2CO+O2«2CO2
∆H= -568 кДж/моль
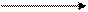 Прямая реакция экзотермическая
Прямая реакция экзотермическая
 Обратная реакция эндотермическая
Обратная реакция эндотермическая
Условия смещения равновесия в стороны продукта:
1. Увеличение концентрации O2
2. Увеличение давления
3. Понижение температуры.
7.3. Примеры решения задач.
Пример1. Как изменится скорость реакции 2Н2+О2=2Н2О при увеличении концентрации водорода в 2 раза.
V1=K1[H2]2[O2]
V2=K2[H2]2[O2]
[O2] не изменилось, К – не зависит от концентрации следовательно отношение скорости V2 (с изменением [Н2]) к V1 – начальной скорости, имеет вид:
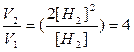 |
то есть скорость реакции возрастает в 4 раза.
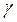 Пример2. При 800С некоторая реакция заканчивается за 16 минут. Сколько потребуется времени для проведения той же реакции при 1200С. Температурный коэффициент реакции =2.
Пример2. При 800С некоторая реакция заканчивается за 16 минут. Сколько потребуется времени для проведения той же реакции при 1200С. Температурный коэффициент реакции =2.
Решение: в соответствии с правилом Вант – Гоффа.
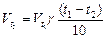 | 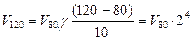 | ||
;
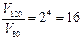 отсюда
отсюда
Таким образом, скорость реакции при повышении температуры от 80 до 1200С возрастает в 16 раз, следовательно, для проведения реакции потребуется в 16 раз меньше времени, то есть 1 минута.
Пример 3. Равновесие реакции H2+J2↔2HJ установилось при следующих концентрациях [H2]=0.5 моль/л, [J2]=0.1 моль/л, [HJ]=1.8 моль/л. Определите исходные концентрации йода и водорода и константу химического равновесия.
Решение: Из уравнения реакции следует, что к моменту равновесия израсходовано 0,9 моль/л водорода и столько же йода. Следовательно, исходная концентрация водорода составляла 0,5+0,9=1,4 моль/л, а исходная концентрация йода 0,1+0,9=1 моль/л
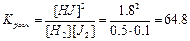 |
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
РСl5(г)=РС1з(г)+С12(г); ∆Н = +92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — РС15?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье: а) так как реакция разложения PC15 эндотермическая (∆H>0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5, так и уменьшением концентрации РС13 или С12.
7.4.Задания для контрольной работы
121. Окисление серы и ее диоксида протекает по уравнениям:
а) S(к)+O2=SO2(к); б) 2SO2(r)+O2=2SO3(r).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
122. Напишите выражение для константы равновесия гомогенной системы N2+3H2= 2NH3. Как изменится скорость прямой реакции — образования аммиака, если увеличить концентрацию водорода в три раза?
123. Реакция идет по уравнению N2+ O2=2NO. Концентрации исходных веществ до начала реакций были: [N2] =0,049 моль/л; [O2]=0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] =0,005 моль/л. Ответ: [N2] =0,0465 моль/л; [О2] =0,0075 моль/л.
124. Реакция идет по уравнению N2+3H2=2NH3. Концентрации участвующих в ней веществ были: [N2]=0,80 моль/л; [Н2] =1,5 моль/л; [NH3]=0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2]= 0,5 моль/л. Ответ: [NH3]=0,70 моль/л; [Н2]=0,60 моль/л.
125. Реакция идет по уравнению H2+J2=2HJ. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [H2] =0,04 моль/л; [J2]=0.05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [Н2]=0,03 моль/л. Ответ: 3,2*10-4; 1.92 *10-4
126. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру
от 120 до 80° С. Температурный коэффициент скорости реакции 3.
127. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60° С, если температурный коэффициент скорости данной реакции 2?
128. В гомогенной системе CO+ С12=СОС12 равновесные концентрации реагирующих веществ: [СО] =0,2 моль/л; [C12]=O,3 моль/л; [СОСl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО. Ответ: К=20; [Сl2]исх=1,5 моль/л; [СО]исх,= 1,4 моль/л.
129. В гомогенной системе А+2В=С равновесные концентрации реагирующих газов: [А] =0,06 моль/л; [В] =0,12 моль/л; [С] =0,216 моль/л. Вычислите константу равновесня системы и исходные концентрации веществ А к В. Ответ: K=2,5; [А]исх=0,276 моль/л; [B]исх=0,552 моль/л.
130. В гомогенной газовой системе A+B=C+D равновесие установилось при концентрациях: [В] =0,05 моль/л и [С] =0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [A]исх=0,22 моль/л; [B]исх=0,07 моль/л.
131. Константа скорости реакции разложения
N2O, протекающей по уравнению 2N2O=2N2+O2, равна 5-104: Начальная концентрация N2O=6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50% N2O. Ответ: 1,8-10~2; 4,5-10~3.
132. Напишите выражение для константы равновесия гетерогенной системы СО2+С=2СО. Как изменится скорость прямой реакции — образования СО, если концентрация СО2 уменьшится в 4 раза? Как следует изменить давление, чтобы повысить выход СО?
133. Напишите выражение для константы равновесия гетерогенной системы С+Н2О(г)=СО+Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции — образования водяных паров?
134. Равновесие гомогенной системы:
4НС1 (г)+О2=2Н2О (г) +2С12 (г)
установилось при следующих концентрациях реагирующих веществ [H2O]p =0,14 моль/л; [С12]р=0,14 моль/л; [НС1]Р=0,20 моль/л; [О2]р=0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [HCl]исх =0,48 моль/л; [О2]Исх=0,39 моль/л.
135. Вычислите константу равновесия для гомогенной системы:
СО(г)+Н2О(г)=СО2(г)+Н2(г).
если равновесные концентрации реагирующих веществ: [CO]p=0,004 моль/л; [H2O]P=0,064 моль/л; [СО2]Р= 0,016 моль/л; [H2]Р=0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: K=l; [H2O]исх =0,08 моль/л; [CO]исх=0,02 моль/л.
136. Константа равновесия гомогенной системы:
СО (г) +H2O(r)=CO2+ Н2(г)
при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, &ли исходные концентрации: [СО]исх=0,10 моль/л; [Н2О]исх=0,40 моль/л. Ответ: [СО2]р=[Н2]р = 0,08 моль/л; [Н2О]Р=0.32 моль/л; [СО]р=0.02 моль/л.
137. Константа равновесия гомогенной системы N2+3H2=2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота. Ответ: [N2]P=8 моль/л; [N2]исх=8,04 моль/л.
138. При некоторой температуре равновесие гомогенной системы 2NO+O2=2NO2 установилось при следующих концентрациях реагирующих веществ: [NO]p=0,2 моль/л; [О2]р=0,1 моль/л; [NO2]p=0,l моль/л. Вычислите константу равновесия и исходную концентрацию NО и О2. Ответ: К=2.5; [NO]ИСХ=0,3 моль/л; [O2]ИСХ=0,15 моль/л.
139. Почему при изменении давления смещается равновесие системы N2+3H2=2NH3 и не смещается равновесие системы N2+O2=2NO? Ответ мотивируйте на основании расчета скорости и обратной реакции в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
140. Исходные концентрации [NO]исх и [Сl2]исх в гомогенной системе 2NO+CI2=2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Ответ: 0,416.
| <== предыдущая страница | | | следующая страница ==> |
| Энергия Гиббса | | | КОЛЛОИДНЫЕ РАСТВОРЫ |
Дата добавления: 2014-09-08; просмотров: 1299; Нарушение авторских прав

Мы поможем в написании ваших работ!