
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЗАНЯТИЕ №11
Тема: Свойства растворов электролитов. Электролитическая диссоциация.
Актуальность темы: Биологические жидкости и ткани содержат много различных электролитов: NaCI, KCI, HCI, CaCI2, NaH2PO4, NaHCO3 и др. Устойчивость биологических высокомолекулярных соединений (белков, нуклеиновых кислот и др.) и скорость многих биохимических реакций зависит от природы и концентрации, присутствующих в жидкостях и тканях ионов. С мочой и потом из организма теряется значительное количество электролитов. Концентрация ионов в тканях поддерживается примерно постоянной, что называется ионным гомеостазом. Прием и выделение солей тесно связаны с обменом воды.
При длительной жажде объем внеклеточного пространства тканей уменьшается за счет уменьшения количества воды. Это приводит к увеличению концентрации ионов. Для компенсации повышения осмотического давления с мочой удаляются ионы Na+ и CI-. Если в результате некоторых заболеваний происходит выделение мочи с повышенным содержанием солей, то вместе с солью организм теряет и воду. При этом уменьшается концентрация ионов в плазме крови, что приводит к снижению осмотического давления в крови. Как видно, концентрация ионов регулирует распределение воды между внеклеточным пространством и клетками тканей, а также между внеклеточным пространством и мочой.
Кислотно-щелочное равновесие в крови и биожидкостях определяется содержанием слабых и сильных электролитов: Na2HPO4, NaH2PO4, H2CO3, NaHCO3 и др. Для понимания механизма их действий необходимо знать процессы диссоциации и их количественную характеристику – константу диссоциации. Особенности метаболического обмена ионов имеют большое значение для жизнедеятельности организмов.
Учебные цели: ознакомиться с расчетами степени и константы диссоциации слабых электролитов, активности и коэффициента активности сильных электролитов, а также влиянием природы растворителя, температуры, концентрации электролита, одноименных и посторонних ионов на степень диссоциации электролитов.
В результате освоения темы студент должен уметь:
· Рассчитывать степень и константу диссоциации слабых электролитов;
· Рассчитывать ионную силу, коэффициент активности и активность ионов в растворах сильных электролитов;
· Прогнозировать направления протекания реакций с участием электролитов и управлять равновесиями в растворах электролитов.
Для формирования умений студент должен знать:
· Основные положения современной теории растворов и теорию электролитической диссоциации;
· Закон разведения В. Оствальда;
· Теорию растворов сильных электролитов П. Дебая и Э. Хюккеля;
· Алгоритм расчетов активности ионов в растворах.
Вид занятий: лабораторно-практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: штатив с пробирками, мерные пипетки на 2 и 5 мл, груши, глазные пипетки, стакан с горячей водой, шпатель.
Реактивы: 0,1 м растворы HCI и CH3COOH; металлический цинк; H2SO4(конц) и 1 М раствор H2SO4; спиртовой раствор CuCl2, сухая соль CH3COONa, раствор метилоранжа, вода очищенная.
Содержание занятия
1. Контроль исходного уровня знаний и умений (тест).
2. Разбор теоретических вопросов и решене задач по определению константы и степени диссоциаций слабых электролитов, ионной силы, коэффициента активности и активности ионов в растворах сильных электролитов.
3. Выполнение лабораторной работы;
а) влияние природы электролита на скорость реакции;
б) влияние концентрации электролита на природу продуктов реакции и на ее скорость;
в) влияние природы растворителя на диссоциацию электролита;
г) влияние одноименных ионов на степень диссоциации электролита.
4. Выходной контроль знаний и умений студентов. Проверка протоколов лабораторной работы
5. Подведение итогов занятия. Задание на дом по теме: «Протолитические процессы в реакциях диссоциации и гидролиза».
Вопросы и упражнения для подготовки к занятию
1. Как подразделяется вещества по их способности проводить электрический ток?
2. Как делятся электролиты по их способности диссоциировать? Приведите примеры электролитов различной силы.
3. Что такое степень диссоциации? Какова ее размерность?
4. В чем сущность теории электролитической диссоциации С. Аррениуса?
5. Что такое «кислота» и «основание» по Аррениусу?
6. В чем роль растворителя в процессе диссоциации электролитов?
7. Какие факторы влияют на степень диссоциации? Каково их влияние?
8. В чем сущность закона разведения В. Оствальда? Его математическое выражение.
9. Что такое ступенчатая диссоциация и как связаны константы ступенчатых диссоциаций с общей константой диссоциации электролита? Показать на примерах.
10. Подчиняются ли сильные электролиты закону разведения Оствальда? Почему?
11. В чем сущность теории сильных электролитов Дебая-Хюккеля?
12. Что такое ионная сила? Коэффициент активности? Активность? Как их рассчитывают?
13. В каких случаях реакции между растворами электролитов идут практически до конца?
14. В чем сущность сокращенных ионных уравнений реакций?
15. Напишите уравнения реакции диссоциации следующих электролитов: сульфата меди (II), карбоната аммония, сульфата калия и хрома (III), дигидрофосфата натрия, гидроксосульфата алюминия, тетрагидроксоалюмината калия.
16. Между какими парами веществ возможны реакции:
а) K2CO3 + CaCI2; б) AI(NO3)3+CrCI3; в) MgSO4+Na3PO4; г) CuCI2+K2SO4; д) AICI3+NaOH.
В тех случаях, когда возможно протекание реакции, напишите уравнения реакций в молекулярном и ионном видах.
17. По данным сокращенным ионным уравнениям составьте ионно-молекулярные и молекулярные уравнения реакций:
а) Cr(OH)3 + 3H+ = Cr3+ + 3H2O;
б) Cr(OH)3 + 3OH- = [Cr(OH)6]3-;
в) 2CO 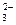 + 2Mg2+ + H2O = (MgOH)2CO3+CO2;
+ 2Mg2+ + H2O = (MgOH)2CO3+CO2;
г) Ca2+ + 2OH- = Ca(OH)2;
д) PO 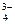 + 3H+ = H3PO4;
+ 3H+ = H3PO4;
е) 3Ca2+ + 2PO 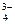 = Ca3(PO4)2.
= Ca3(PO4)2.
18. Закончите данные уравнения реакций:
а) CuSO4 + NH3 →
б) AI4C3 + H2O →
в) CrCI3 + K2S + H2O →
г) H3PO4 + NaOH →
д) Ca3(PO4)2 + H2SO4(конц) →
е) Cr2(SO4)3 + KOH →
Приведите молекулярно-ионные и сокращенные ионные уравнения реакций.
Литература:
[1] c. 80; [3] с. 111; [4] с. 18.
Дополнительная:
1. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. т.1. -М., 1998.
2. Ахметов Н.С. Общая и неорганическая химия. -М., Высшая школа. 2002.
Образец билета входного тест-контроля
1. Электролитами являются:
А) C2H5OH Б) NaOH В) CH3COOH
Г) SiO2 Д) CaCI2
Ответ: Б,В,Д.
2. При диссоциации 1 моль Cr2(SO4)3 образуется:
А) 2 моль иона Б) 3 моль иона В) 5 моль иона
Г) 6 моль иона Д) 4 моль иона.
Ответ: В.
3. Первую теорию диссоциации электролитов создал:
А) Аррениус Б) Дебай В) Каблуков
Г) Менделеев Д) Оствальд
Ответ: А.
4. Степень диссоциации электролита зависит от:
А) температуры Б) природы растворителя
В) времени Г) концентрации
Д) присутствия одноименных ионов Е) давления
Ответ: А,Б,Г,Д.
5. Ионы, участвующие в реакции NaHCO3 + HCI = NaCI + CO2 + H2O:
А) Na+ Б) CI- В) H+
Г) CO 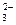 Д) HCO
Д) HCO 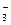
Ответ: В,Д.
6. Какие реакции протекают до конца?
А) CuCI2+Na2SO4 Б) BaCI2+Sr(NO3)2 В) SrCI2+Li2SO4
Г) (NH4)2C2O4+CaCI2 Д) CH3COONa+H2SO4
Ответ: В,Г,Д.
7. Степень диссоциации слабого электролита при увеличении концентрации его:
А) возрастает
Б) не меняется
В) уменьшается
Г) сначала возрастает, затем остается постоянной
Д) сначала уменьшается, затем возрастает
Ответ: В.
8. Какой из электролитов при их одинаковой концентрации имеет более низкую ионную силу:
А) K2SO4
Б) KCI
В) CaCI2
Г) CuSO4
Д) AI2(SO4)3
Ответ: Б.
9. Сумма коэффициентов в левой части для сокращенного ионного уравнения реакции CaCI2 + K3PO4 → Ca3(PO4)2 + KCI:
А) 2 Б) 4 В) 5 Г) 3 Д) 6
Ответ: В.
10. Даны 2 раствора: 1) 0,1 м CH3COOH и 2) 0,1м C2H5OH. Осмотические давления этих растворов соотносятся:
А) P1 > P2 Б) P2 > P1 В) P1 = P2
Ответ: А.
Информационная часть
Электролитами называются проводящие электрический ток расплавы, растворы и сами вещества. Все вещества по их поведению в растворах делят на 2 группы:
· вещества, растворы которых проводят электрический ток (электролиты);
· вещества, растворы которых не обладают электропроводностью (неэлектролиты).
К электролитам относится большинство неорганических кислот, оснований и солей. Изучая свойства растворов электролитов Вант-Гофф обнаружил, что они обладают боле низкими значениями температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе при тех же концентрациях. Для объяснения этих фактов шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации. Распад молекул электролитов на ионы в растворителях называют электролитической диссоциацией или ионизацией. При этом образуются положительно заряженные ионы – катионы и отрицательно заряженные ионы – анионы.
Процесс диссоциации является обратимым. Различные электролиты диссоциируют на ионы в различной степени. Полнота распада зависит от природы электролита, его концентрации, температуры, природы растворителя, присутствия одноименных и других ионов и веществ.
В развитии теории С. Аррениуса значительна роль русских ученых И.А. Каблукова и В.А. Кистяковского, которые показали роль сольватации молекул в процессе диссоциации их на ионы. Роль растворителя заключается не только в создании условий для поляризации и разделения ионов противоположного знака, но и в замедлении их рекомбинации. Перешедшие в раствор ионы сольватированы (в случае воды – гидратированы), и в результате диссоциации образуются относительно устойчивые соединения ионов с молекулами растворителя – сольваты ионов (гидраты ионов). Число молекул растворителя в сольватной оболочке непостоянно, а зависит от природы ионов, температуры и концентрации раствора. При написании уравнений диссоциации, а также ионных уравнений, обычно сольватную оболочку не указывают. Например,
CH3COOH « CH3COO- + H+
или CaCO3 + 2H+ = Ca2+ + CO2 + H2O.
Важной характеристикой любого электролита является степень его диссоциации (или степень ионизации).
Степень диссоциации – это отношение числа молекул вещества, распавшихся на ионы, к общему числу его молекул в растворе.
Это количественная характеристика силы электролита.
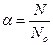 или
или 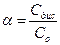 ,
,
т.к. концентрация пропорциональна числу молекул и ионов в растворе. Степень диссоциации выражается в долях или процентах.
Все электролиты условно делятся на:
· сильные электролиты, если α ≥ 30%;
· слабые электролиты, если α ≤ 3%;
· электролиты средней силы, если 3%<α<30%.
Экспериментально степень диссоциации (α) определяют, измеряя отклонения коллигативных свойств растворов электролитов от теоретических значений для идеальных растворов (через изотонический коэффициент):
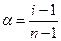 , где
, где
n – число ионов, на которые распадаются молекулы,
i – изотонический коэффициент.
На степень диссоциации влияют:
· Температура. Как правило, для большинства электролитов степень диссоциации возрастает с температурой.
· Концентрация раствора. С увеличением концентрации степень диссоциации уменьшается.
· Одноименные ионы. Введение одноименных ионов приводит к уменьшению степени диссоциации.
· Посторонние сильные электролиты. Обычно приводят к некоторому увеличению степени диссоциации, из-за увеличения ионной силы раствора.
Количественно электролитическую диссоциацию можно выразить также через константу диссоциации, которая получается путем применения закона действующих масс к обратимому процессу диссоциации. Так для слабых электролитов В. Оствальд установил связь между константой диссоциации и степенью диссоциации. Эта зависимость получила название закона разведения Оствальда. Математическое выражение его:
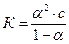 , где
, где
K – константа диссоциации;
a – степень диссоциации;
с – концентрация электролита.
Для очень разбавленных растворов, когда c → 0 имеем 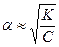 . Если ввести
. Если ввести 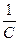 =V (разбавление), то
=V (разбавление), то 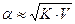 .
.
Степень диссоциации слабого электролита возрастает с разбавлением раствора.
Сильные электролиты не подчиняются закону разведения Оствальда.
Многоосновные кислоты и многокислотные основания диссоциируют в растворах ступенчато. Например, для H3PO4:
H3PO4 « H+ + H2PO 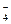 K1
K1
H2PO 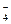 « H+ + HPO
« H+ + HPO  K2
K2
HPO  « H+ + PO
« H+ + PO 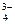 K3
K3
По первой ступени H3PO4 – кислота средней силы, а по второй и третьей ступеням – слабая. Суммарно это можно показать:
H3PO4 « 3H+ + PO 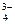 Kобщ
Kобщ
Математически можно показать, что:
Kобщ=K1∙K2∙K3.
Для характеристики силы электролита пользуются также показателем константы диссоциации (pK):
рК = -lgK
Чем больше значение pK, тем электролит слабее и наоборот.
Практически полная диссоциация сильных электролитов на ионы вне зависимости от концентрации их растворов подтверждается физическими и физико-химическими методами исследования.
В 1923 г П. Дебай и Э. Хюккель установили закон ионной силы.
В разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны независимо от их химической природы.
Математическое выражение закона ионной силы имеет вид:
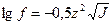 , где
, где
f – коэффициент активности;
z – заряд катиона или аниона;
J – ионная силы раствора.
Ионной силой раствора называют полусумму произведения концентраций всех находящихся в растворе ионов на квадрат их заряда.
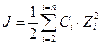 , где
, где
сi – концентрация ионов;
zi – их заряд;
i – число ионов.
Зная ионную силу можно рассчитать коэффициент активности, а последний позволяет найти активность ионов (а) в растворе.
а = f × c, где
f – коэффициент активности;
с – концентрация иона.
Активность иона – эта эффективная концентрация его, в соответствии с которой он участвует в различных процессах. Активность имеет такую же размерность, что и концентрация (моль/л).
Отклонение активности от концентрации возникает за счет образования вокруг каждого иона так называемой «ионной атмосферы» из противоположно заряженных ионов. Ионная атмосфера тормозит движение иона и уменьшает его подвижность. При бесконечном разведении с ® 0 имеем а = с, т.к. f = 1. В очень разбавленных растворах сильных электролитов можно принять а » с.
Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакции часто используют так называемые ионные уравнения. Последние подчеркивают тот факт, что в растворах происходят реакции не между молекулами, а между ионами.
Согласно теории электролитической диссоциации при реакциях в растворах электролитов возможны 2 варианта:
· Образующиеся вещества – сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
· Одно или несколько из образующихся веществ – газ, осадок или хорошо растворимый в воде слабый электролит.
K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
2K+ + CO 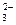 + 2H+ + SO
+ 2H+ + SO  = 2K+ + SO
= 2K+ + SO  + CO2 + H2O
+ CO2 + H2O
CO 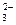 + 2H+ = CO2 + H2O
+ 2H+ = CO2 + H2O
Последнее уравнение называют сокращенным ионным уравнением реакции, которое получается после сокращения повторяющихся ионов. Сокращенное ионное уравнение показывает, что при действии на любые растворимые карбонаты сильными кислотами выделяются СО2 и Н2О.
В этом практическая ценность сокращенных ионных уравнений, их широко используют как качественные реакции на различные ионы.
Из рассмотренного выше материала, можно вывести правило: «Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов». Это правило справедливо для разбавленных водных растворов при комнатной температуре.
Разбор типовых задач
1. Из приведенных веществ выберите те, которые в водных растворах диссоциируют на ионы. Напишите возможные реакции между этими веществами в водных растворах в молекулярном и ионном видах: глюкоза, формиат калия, соляная кислота, гидроксид кальция, ацетон, сульфат железа (III).
Решение: Из приведенных веществ на ионы диссоциируют формиат калия, соляная кислота, гидроксид кальция и сульфат железа (III). В водных растворах возможны реакции:
1) НСООК + НС1 = НСООН + КС1 или
НСОО- + Н+ = НСООН
2) 2НС1 + Са(ОН)2 = СаС12 + 2Н2О или
2Н+ + Са(ОН)2 = Са2+ + 2Н2О
3) 3Са(ОН)2 + Fe2(SO4)3 = 2Fe(OH)3¯ + 3CaSO4¯ или
3Са(ОН)2 + 2Fe3+ + 3SO  = 2Fe(OH)3¯ + 3CaSO4¯
= 2Fe(OH)3¯ + 3CaSO4¯
Эти реакции возможны потому, что в первом случае образуется слабый электролит НСООН, во втором случае – Н2О, а в третьем случае образуются осадки Fe(OH)3 и CaSO4.
2. Запишите выражения для констант диссоциации слабого основания Zn(OH)2 по отдельным ступеням. По какой из ступеней диссоциация происходит сильнее?
Решение: Молекулы многоосновных кислот и многокислотных оснований диссоциируют ступенчато, и каждая равновесная стадия характеризуется своей константой равновесия – константой диссоциации:
1-ая ступень Zn(OH)2 « Zn(OH)+ + OH-
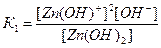
2-ая ступень Zn(OH)+ « Zn2+ + OH-
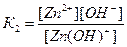
В результате 1-ой ступени ОН- - ионы отщепляются от нейтральной молекулы Zn(OH)2, в результате 2-ой ступени частица ОН- отщепляется уже от положительно заряженного иона Zn(OH)+, что, очевидно, требует гораздо большей затраты энергии. Поэтому количество ионов, образующихся по 2-ой стадии будет значительно меньше, чем по 1-ой, т.е. диссоциация протекает в меньшей степени. Этот качественный вывод подтверждается численными значениями соответствующих констант диссоциации: К1=4,4×10-5; К2=1,5×10-9. Итак, К1>К2.
3. Оцените степень диссоциации в 0,005 М и 0,05 М растворах H2SO3.
Решение: Для решения следует использовать закон разведения Оствальда и значения констант диссоциации Н2SO3. Сернистая кислота – слабый электролит, диссоциирует ступенчато:
H2SO3 « H+ + HSO 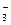 К1 = 1,7×10-2
К1 = 1,7×10-2
HSO 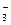 « H+ + SO
« H+ + SO 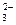 К2 = 6,3×10-8
К2 = 6,3×10-8
Поскольку К2<<К1, то диссоциацией кислоты по 2-ой ступени можно в первом приближении пренебречь и рассчитывать a для 1-ой ступени диссоциации. С другой стороны, значение К1 относительно велико (>10-4), поэтому расчет a следует проводить по полной формуле Оствальда:
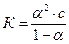 или сa2 + ka - k = 0
или сa2 + ka - k = 0
Для 0,005 М раствора:
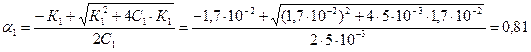
Расчет по приближенной формуле (K»α2c) приводит к величине α>1, что не имеет смысла.
Для 0,05 М раствора:
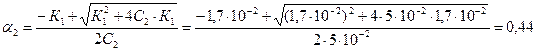
Видно, что с уменьшением концентрации слабого электролита α увеличивается. При бесконечном разбавлении раствора степень диссоциации стремится к единице: α∞→1.
4. Чему равна ионная сила раствора, содержащего 2,5 г CaC12 и 1,5 г NaC1 в 0,5 л раствора?
Решение: Ионная сила такого раствора рассчитывается по формуле:
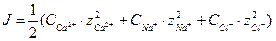
Концентрации ионов молярные, поэтому подсчитаем молярные концентрации солей по формуле:
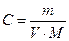
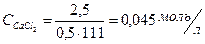 ;
; 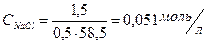
СаС12 и NaС1 сильные электролиты, приняв, что при таких концентрациях они диссоциируют полностью, имеем:
СаС12 = Са2+ + 2С1-
NaCl = Na+ + С1-
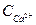 = 0,045 моль/л;
= 0,045 моль/л; 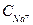 = 0,051 моль/л;
= 0,051 моль/л;
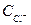 = 2 ∙ 0,045 + 0,051 = 0,141 моль/л.
= 2 ∙ 0,045 + 0,051 = 0,141 моль/л.
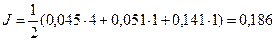
Ответ: J = 0,186.
5. Чему равна активность ионов H+ в 0,02 М растворе HNO3?
Решение: Активность ионов рассчитывается по формуле: 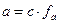 , a коэффициент активности – по формуле:
, a коэффициент активности – по формуле: 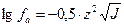 .
.
Рассчитаем сначала ионную силу раствора:
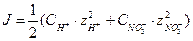
Из HNO3 = H+ + NO  имеем С
имеем С 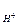 = 0,02 моль/л; С
= 0,02 моль/л; С 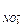 = 0,02 моль/л
= 0,02 моль/л

Затем 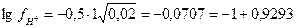 или
или 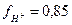 .
.
Окончательно, а 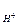 = 0,85 × 0,02 = 0,017 моль/л.
= 0,85 × 0,02 = 0,017 моль/л.
Видно, что активность ионов Н+ несколько меньше его концентрации.
Лабораторная работа
Задание 1. Изучение влияния природы электролита на скорость реакции.
В две пробирки одинакового размера налейте мерной пробиркой по 5 мл 1 М HCl (в первую пробирку) и 1 М CH3COOH (в другую пробирку). В обе пробирки опустите по равному кусочку металлического цинка. Обе пробирки поместите в стакан с горячей водой (60-70°С). Наблюдайте выделение газа (какого?) и отметьте, в какой пробирке газ выделяется более интенсивно. Напишите уравнение протекающих реакций в молекулярной и ионной формах. Дайте объяснение наблюдаемому явлению исходя из зависимости скорости реакции от концентрации реагирующих веществ.
Задание 2. Изучение влияния концентрации электролитов на природу продуктов реакции и на скорость реакции.
В две пробирки одинакового размера налейте по 3 мл (мерной пробиркой) 1 М H2SO4 (в первую пробирку) и концентрированную H2SO4 (во вторую пробирку). В обе пробирки опустите по равному кусочку цинка. Затем обе пробирки поместите в стакан с горячей водой (60-70°С). Наблюдайте выделение газа в каждой пробирке (каких?) и скорость выделения газов. Напишите уравнения протекающих реакций в молекулярном и ионном видах и объясните выделение газов, и скорость их выделения исходя из природы концентрированной и разбавленной серной кислоты в окислительно-восстановительных реакциях и влияния концентрации вещества на скорость реакции.
Задание 3. Изучение влияния природы растворителя на характер диссоциации электролита.
В пробирку внесите 2 мл спиртового раствора хлорида меди (II), обратив внимание на цвет раствора. Содержимое пробирки разделите на 2 равные части. Одну пробирку оставьте для сравнения, а в другую добавьте 2-3 мл дистиллированной воды. Наблюдайте изменение окраски раствора во второй пробирке. Дайте объяснение наблюдаемому явлению, исходя из диэлектрической проницаемости воды (78) и спирта этилового (24).
Задание 4. Изучение влияния одноименных ионов на степень диссоциации электролита.
В две пробирки одинакового размера налейте по 4 мл 0,1 М раствора CH3COOH. В каждую пробирку добавьте по 2 капли индикатора метилового оранжевого. В одну из пробирок микрошпателем внесите несколько кристаллов CH3COONa и раствор перемешайте до полного растворения соли. Отметьте изменение окраски раствора во второй пробирке. Объясните данное явление исходя из закона действия масс. Напишите уравнение реакции ионизации слабого электролита CH3COOH.
Ситуационные задачи для контроля усвоения темы
1. Даны водные растворы следующих веществ: бромид калия, нитрат хрома (III), гидроксид натрия, нитрат свинца (II), серная кислота, хлорид бария. Напишите возможные реакции между этими веществами в молекулярном и ионном видах и объясните, почему они протекают.
2. Какие пары веществ не могут вместе существовать: а) хромат калия и нитрат бария; б) серная кислота и хлорид бария; в) бромид железа (III) и нитрат кальция; г) иодид аммония и гидроксид калия; д) нитрат бария и хлорид калия? Ответ обоснуйте соответствующими уравнениями реакций в молекулярном и ионном видах.
3. Найти ионную силу раствора, содержащего 7,45 г KCl и 0,01 моль K2SO4 в 1 л раствора.
4. Уксусная кислота в 0,76% -ном растворе (плотность 1 г/мл) ионизирована на 0,19%. Вычислите константу ионизации.
5. Чему равны активности ионов Ca2+ и Cl- в 0,02 М растворе CaCl2?
6. Имеются два раствора с одинаковой молярной концентрацией: хлорид калия и сульфат магния. Какой из этих растворов имеет большее значение ионной силы? Дайте краткое пояснение.
7. Значения изотонического коэффициента некоторых электролитов при разбавлении водного раствора стремятся к: а)2; б)3; в)4. Приведите по 2 примера каждого типа электролитов.
8. Рассчитайте ионную силу плазмозамещающего раствора «Трисоль», который готовят по прописи:
· натрия хлорид 0,5 г
· калия хлорид 0,1 г
· натрия гидрокарбонат 0,4 г
· вода для инъекций до 100 мл
9. Водные растворы сульфата цинка с массовой долей 0,1%; 0,25% и 0,5% применяются в качестве глазных капель как антисептическое и вяжущее средства. Рассчитайте активность иона цинка в таких растворах. Плотность каждого раствора условно принять равной 1 г/мл.
10. При лечении маниакальных состояний препаратами лития (в виде LiCl) концентрация иона лития в плазме должна быть не ниже 0,6 ммоль/л и не выше 1,6 ммоль/л. Вычислите диапазон активностей иона лития в плазме.
Образец билета выходного контроля
1. Какие реакции не протекают до конца при комнатной температуре:
А) NH4Cl+KOH Б) CaJ2+Pb(NO3)2
В) KCl+Al(NO3)3 Г) H2SO4+BaCl2
Д) HNO3+CaCl2
Ответ: А,В,Д.
2. Сумма коэффициентов левой части для сокращенного ионного уравнения реакции: АgNO3 + K2CrO4 → … равна:
А) 2 Б) 3 В) 4 Г) 5 Д) 6
Ответ: Б.
3. В водный раствор CH3COOH добавлена некоторая масса CH3COONa. При этом степень ионизации уксусной кислоты:
А) возрастает Б) убывает
В) не изменяется Г) сначала возрастает, затем убывает
Д) сначала убывает, затем возрастает
Ответ: Б.
4. Разбавленный раствор NH4Br и разбавленный раствор H2SO4 замерзают при одинаковой температуре. Массовая доля какого вещества больше в растворе?
А) кислоты Б) соли В) они равны.
Ответ: Б.
5. Ионная сила плазмозамещающего раствора «Хлосоль», который готовят по прописи:
· натрия ацетат 0,36 г
· натрия хлорид 0,475 г
· калия хлорид 0,15 г
· вода для инъекций до 100 мл равна:
А) 0,145 Б) 0,044 В) 0,081 Г) 0,125 Д) 0,101
Ответ: А.
Домашнее задание
Тема: «Протолитические процессы в реакциях диссоциации и гидролиза».
Литература: [1] с. 95; [3] с. 120; [4] с. 30.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАНЯТИЕ №10 | | | ЗАНЯТИЕ №12 |
Дата добавления: 2014-09-10; просмотров: 614; Нарушение авторских прав

Мы поможем в написании ваших работ!