
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЗАНЯТИЕ №12
Тема: Протолитические процессы в реакциях диссоциации и гидролиза.
Актуальность темы: Для живых организмов характерно поддержание кислотно-основного состояния на определенном уровне. Это находит выражение в достаточно постоянных значениях рН биологических сред и в способности восстановления рН при воздействии на эти среды протолитов. Несмотря на то, что в процессе метаболизма в организме постоянно образуются кислоты, рН тканей поддерживается примерно постоянным. Совокупность механизмов поддерживающих протолитический гомеостаз, включает в себя физико-химические механизмы и физиологические механизмы (легочную и почечную компенсацию). Для понимания физико-химических механизмов необходимо ознакомиться современными понятиями «кислота», «основание», «протолиз» в различных типах реакций.
Учебные цели: сформировать системные знаний по теории кислотно-основных равновесий для обоснования протекающих в условиях живых систем процессов протолиза.
В результате освоения темы студент должен уметь:
· Определять кислоты и основания на основании протолитической теории;
· Определять амфолиты, показать, когда амфолиты ведут себя как кислоты и когда они проявляют основные свойства;
· Написать константы кислотности и основности, и по ним оценить силу кислот и оснований;
· Рассчитывать рН в растворах кислот или оснований;
· Предвидеть среду, которая создается при гидролизе различных солей;
· Рассчитывать рН, степень и константу гидролиза различных типов солей;
· Определять рН среды при помощи универсальной индикаторной бумаги.
Для формирования умений студент должен знать:
· Сущность протолитической теории кислот и оснований, классификацию кислот, оснований и амфолитов;
· Расчетные формулы констант кислотности и основности, рН в растворах сильных и слабых кислот и оснований в водных растворах;
· Основные случаи гидролиза солей и смещение протолитических равновесий при гидролизе солей;
· Расчетные формулы константы и степени гидролиза, а также рН в растворах гидролизующихся солей;
· Способы экспериментального определения рН в водных растворах кислот, оснований и солей.
Вид занятий: лабораторно-практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: штатив с пробирками, универсальная индикаторная бумага, мерные пробирки на 10 мл, калькулятор, справочник физико-химических величин, водяная баня.
Реактивы: 0,1 м растворы HCI и NaOH, CH3COOH и NH3; 0,1 м растворы Na2CO3, Na2SO4, NH4Cl, KNO3, CH3COONa, Al2(SO4)3, CH3COONH4, дистиллированная вода, индикаторы фенолфталеин, синяя лакмусовая бумага.
Содержание занятия
1. Контроль исходного уровня знаний и умений (тест).
2. Разбор теоретических вопросов и решений задач.
3. Выполнение лабораторной работы;
а) определение рН водных растворов слабых и сильных кислот и оснований колориметрическим способом (при помощи универсальной индикаторной бумаги);
б) определение рН в водных растворах солей;
в) изучение влияния температуры на степень гидролиза солей;
г) изучение совместного гидролиза солей.
4. Выходной контроль знаний и умений студентов. Проверка протоколов лабораторной работы
5. Подведение итогов занятий. Задание на дом по теме: «Протолитические процессы в буферных растворах».
Вопросы и упражнения для подготовки к занятию
1. В чем принципиальное различие теории кислот и оснований Бренстеда-Лоури от теории С. Аррениуса?
2. Понятия сопряженной кислоты и сопряженного основания.
3. Приведите примеры кислот и оснований:
а) молекулярные,
б) катионные,
в) анионные.
4. Приведите примеры 2-х амфолитов и их взаимодействия с кислотами и основаниями.
5. Что такое константа кислотности и константа основности? Как они связаны для водных растворов?
6. Выразите константы кислотности (ступенчатые и суммарные) для следующих кислот:
а) муравьиной,
б) сернистой,
в) ортоборной.
7. Выразите константы основности (ступенчатые и суммарные) для следующих оснований:
а) гидроксида аммония,
б) гидроксида магния,
в) гидроксида железа (III).
8. Расположите следующие кислоты в порядке возрастания их силы (пользуясь таблицей констант кислотности и основности): фтороводородная, фосфорная, азотная, сернистая, сероводородная, угольная, циановодородная. Для двух- и многоосновных кислот надо брать первые константы кислотности.
9. Покажите ступенчатый гидролиз солей:
а) карбоната калия,
б) хлорида аммония,
в) оксалата аммония.
Какими способами можно подавить гидролиз каждой соли?
10. Напишите молекулярные и ионные уравнения реакций взаимодействия водных растворов:
а) сульфата хрома (III) и карбоната калия,
б) хлорида алюминия и сульфида калия,
в) бромида магния и сульфита натрия.
11. Пользуясь таблицей констант кислотности и основности оцените реакцию среды, которая создается при растворении в воде следующих солей:
а) гидрокарбоната натрия,
б) хлорида марганца (II),
в) формиата аммония,
г) хлорида калия,
д) ацетата аммония.
12. Интервалы перехода окраски индикаторов:
· метилоранжа – от рН 3,1 до 4,4,
· фенолфталеина от рН 8,0 до 10,0.
Какой из индикаторов будете использовать при титровании растворов:
а) уксусной кислоты гидроксидом натрия,
б) аммиака соляной кислотой,
в) азотной кислоты гидроксидом калия?
Дать обоснованный ответ.
Литература:
[1] с. 95; [3] с. 120; [4] с. 30.
Дополнительная:
1. Лекционный материал.
2. Ахметов Н.С. Общая и неорганическая химия. -М., Высшая школа. 2002.
3. Краткий справочник физико-химических величин. Под ред. А.А. Равделя. -Л., Химия. 1983.
4. Данное руководство.
Образец билета входного тест-контроля
1. Кислотами по Бренстенду-Лоури являются:
А) NaHSO4 Б) H2S В) Zn(OH)2
Г) KOH Д) Fe(OH)SO4 Е) NH4Cl
Ответ: А,Б,В,Е.
2. Наиболее сильным основанием является:
А) NH3×H2O Б) Zn(OH)2 В) Ca(OH)2
Г) Mg(OH)2 Д) NH2CH2COOH Е) H2O
Ответ: В.
3. Степень гидролиза Na2SO3 по первой ступени рассчитывается по формуле:
А) 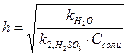 Б)
Б) 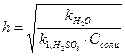 В)
В) 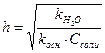
Г) 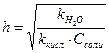 Д)
Д) 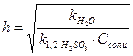 Е)
Е) 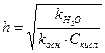
Ответ: А.
4. 0,01 м раствор LiOH создает рН:
А) 2 Б) 7 В) 12 Г) 0 Д) 14
Ответ: В.
5. Наиболее сильно подвергается гидролизу:
А) CH3COONa Б) KCN В) HCOOLi
Г) BaF2 Д) RbJ
Ответ: Б.
6. При гидролизе данной соли практически не меняется рН:
А) NaCl Б) Na2CO3 В) NH4Cl
Г) CH3COONH4 Д) K3PO4 Е) Al(NO3)3
Ответ: Г.
7. При взаимодействии водных растворов хлорида алюминия и карбоната натрия образуются в качестве продуктов реакции:
А) NaCl Б) Al2(CO3)3 В) CO2
Г) Al(OH)3 Д) Al(OH)CO3 Е) NaHCO3
Ответ: А,В,Г.
8. При помощи каких индикаторов можно оценить, что произошел гидролиз карбоната калия:
А) метилоранж Б) фенолфталеин В) крахмал
Г) лакмус Д) метилкрасный
Ответ: Б,Г.
Информационная часть
В современной химии для описания реакций, сопровождающихся изменением кислотно-основных свойств реагирующих веществ, пользуются протолитической теорией Дж. Бренстеда, Т. Лоури и Н. Бьеррума.
В соответствии с положениями этой теории кислота – донор протонов (НВ), основание – акцептор протонов (В). Молекула и ион (или два иона), отличающиеся по составу на передаваемый протон, называется сопряженной кислотно-основной парой. В водных растворах кислот и оснований можно выделить две сопряженные пары, одну из которых образует растворитель. Равновесия, устанавливающиеся в растворах между кислотами и сопряженными основаниями, называются протолитическими (кислотно-основными), а перенос протона от одной частицы к другой – протолизом. Понятия «кислота» и «основание» являются относительными, т.к. одни и те же вещества могут проявлять как кислотные, так и основные свойства – в зависимости от партнера по равновесию.
Реакцию ионизации или диссоциации кислоты в водном растворе можно показать:
| СH3COOH | + | H2O | « | CH3COO- | + | H3O+ |
| кислота 1 | основание 2 | основание 1 | кислота 2 |
Одну сопряженную пара образуют CH3COOH / CH3COO-, другую H2O / H3O+.
Аналогично реакцию диссоциации основания можно показать:
| NH3 | + | H2O | « | NH 
| + | OH- |
| основание 1 | кислота 2 | кислота 1 | основание 2 |
Реакция самоионизации (автопротолиза) воды имеет вид:
| H2O | + | H2O | « | H3O+ | + | OH- |
| кислота 1 | основание 2 | кислота 2 | основание 1 |
Частицы, способные к взаимодействию как с кислотами, так и с основаниями, называются амфолитами. К амфолитам относятся вода, аминокислоты, белки и некоторые другие вещества.
Кислотами могут быть нейтральные молекулы, катионы и анионы. Основаниями также могут быть нейтральные молекулы, анионы и катионы.
Сила кислот определяется их способностью отдавать протон, а оснований – принимать протон. Мерой этой способности служат, соответственно, константа кислотности (ka) и константа основности (kb).
В водном растворе для произвольной кислоты НВ имеем:
НВ + Н2О « В- + Н3О+
Константа равновесия этого процесса:
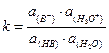
Так как 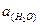 = const, для разбавленных растворов, приняв а » с, имеем:
= const, для разбавленных растворов, приняв а » с, имеем:
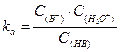
Для полипротонных кислот константы кислотности определяются по каждой ступени. Например, для Н3РО4:
Н3РО4 + Н2О « Н3О+ + Н2РО 
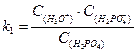
Н2РО 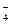 + Н2О « Н3О+ + НРО
+ Н2О « Н3О+ + НРО 
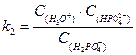
НРО  + Н2О « Н3О+ + РО
+ Н2О « Н3О+ + РО 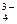
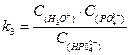
Аналогично, для произвольного основания В имеем:
В + Н2О « ВН+ + ОН- 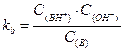
Константы кислотности и основности в сопряженной паре для водного раствора связаны между собой:
kа × kb = k 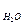 = С
= С 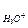 × С
× С 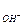
Чем сильнее кислота, тем слабее сопряженное ей основание и наоборот.
Для удобства расчетов пользуются не самими константами, а их показателями, т.е. десятичными логарифмами, взятыми со знаком «минус»:
рKа = -lgKa и рKb = -lgKb
Для водных растворов рKа + рKb = 14 при Т=298о К.
Самой сильной кислотой в водном растворе является ион гидроксония Н3О+, а самым сильным основанием – гидроксид ион ОН-.
Ниже приведена протолитическая шкала – диапазон значений, в котором могут меняться величины рКа протолитов в водном растворе.
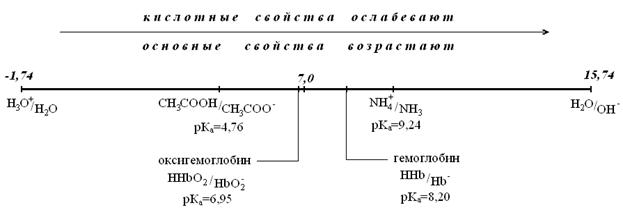
Если в растворе имеются две кислоты или два основания различной силы, то можно показать, что более сильная кислота подавляет ионизацию более слабой кислоты и более сильное основание подавляет ионизацию более слабого основания. Исходя из этого, для сильных кислот в водном растворе можно вывести формулу расчета рН. Если для разбавленных растворов сильных кислот принять степень ионизации равной 1, то:
рН = -lgC(НВ), где
С(НВ) – молярная концентрация одноосновной сильной кислоты.
Аналогично можно показать, для сильных однокислотных оснований:
рН = 14 + lgC(В), где
С(В) – молярная концентрация сильного основания.
Для слабых кислот и оснований необходимо учитывать их степень ионизации. Так, для слабой одноосновной кислоты:
рН = 0,5 (рКа - lgC(НВ)),
а для слабого однокислотного основания:
рН = 14 - 0,5 (рКb - lgC(В)).
В случае ионизации двух- и более основных кислот или двух- и более кислотных оснований, в первом приближении берут первую константу ионизации. Так, для Н2СО3:
рН = 0,5 (рК1 – lgC 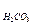 ).
).
Гидролиз – реакция взаимодействия растворенного вещества с водой. Если растворить в воде соли, образованные либо слабой кислотой, либо слабым основанием, значение рН воды будет изменяться за счет протекания реакции между солью и водой. Только растворимые соли, образованные сильными кислотами и сильными основаниями, гидролизу не подвергаются, ибо реакция между сильной кислотой и сильным основанием протекает необратимо.
Различают три случая гидролиза солей:
1. Гидролизу по катиону подвергаются соли, образованные слабым основанием и сильной кислотой, например, NH4Cl.
NH4Cl + HOH « NH3×H2O + HCl или
NH 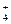 + HOH « NH3×H2O + H+.
+ HOH « NH3×H2O + H+.
При этом рН смещается в кислую сторону, т.е. рН<7. Количественный расчет рН проводится по формуле:
рН = 7 – 0,5рКb – 0,5lgCсоли, где
Ссоли – молярная концентрация соли.
Константа и степень гидролиза (h) солей такого типа связаны с k 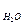 и kb следующим образом:
и kb следующим образом:
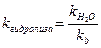 ,
, 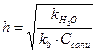
2. Гидролизу по аниону подвергаются соли, образованные слабой кислотой и сильным основанием, например, CH3COONa.
CH3COONa + HOH « CH3COOH + NaOH или
CH3COO- + HOH « CH3COOH + OH-.
При этом рН смещается в щелочную сторону, т.е. рН>7. Количественный рН рассчитывается по формуле:
рН = 7 + 0,5рКа + 0,5lgCсоли
Константа и степень гидролиза солей такого типа связаны с силовыми показателями воды и слабой кислоты следующим образом:
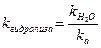 ,
, 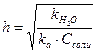
3. Гидролизу по катиону и аниону одновременно подвергаются соли, образованные слабыми кислотами и слабыми основаниями, например, CH3COONН4.
CH3COONН4 + HOH « CH3COOH + NH3×H2O или
CH3COO- + NH  + HOH « CH3COOH + NH3×H2O.
+ HOH « CH3COOH + NH3×H2O.
В этом случае реакция среды определяется тем, какой из этих электролитов сильнее. Если кислота более сильная, чем основание, то создается слабокислая среда, если основание более сильное, чем кислота, то – слабощелочная среда.
Расчет рН для таких солей проводится по формуле:
рН = 7 + 0,5рКа - 0,5рКb
Константа и степень гидролиза рассчитываются по формулам:
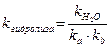 ,
, 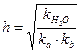 .
.
В последнем случае гидролиз идет глубже, чем в первых двух случаях. Если же соли образованы очень слабыми кислотами, например, H2S, H2CO3 и т.д., и очень слабыми основаниями, например, Fe(OH)3, Al(OH)3, Cr(OH)3 и т.д., то такие соли подвергаются полному необратимому гидролизу и в обменных реакциях в водной среде они не могут образоваться.
Одним из важнейших протолитических показателей в биохимических процессах является рН среды. Известны два способа определения рН.
1. Колориметрический способ основан на использовании кислотно-основных индикаторов, которые представляют собой слабые кислоты или основания, изменяющие свою окраску в обратимых реакциях обмена протонов.
У одноцветных индикаторов молекулярная форма бесцветна, а ионная окрашена. Если взять индикатор – кислоту, то:
| Hind | + | H2O | « | H3O+ | + | Ind- |
| бесцветная форма | окрашенная форма |
К одноцветным индикаторам относятся n-нитрофенол, фенолфталеин, тимолфталеин. Если обе формы индикатора окрашены, то он называется двухцветным. Например, метиловый оранжевый, метиловый красный, бромтимоловый синий.
При добавлении кислоты или щелочи протолитическое равновесие диссоциации индикатора смещается в сторону образования ионной или молекулярной форм, что приводит к перемене окраски всего раствора. Обычно окраска индикаторов меняется в интервале рКа±1, который называется зоной перехода окраски индикатора. Точность измерения рН этим методом составляет ± 0,5 единиц рН. На практике чаще используют смесь индикаторов (универсальный индикатор). Например, смесь Кольтгофа состоит из диметиламиноазобензола, метилового красного, бромтимолового синего, фенолфталеина и тимолфталеина и может изменять окраску в диапазоне от рН 2 до 10:
· рН = 2 окраска красная
· рН = 3 окраска красно-оранжевая
· рН = 4 окраска оранжевая
· рН = 5 окраска желто-оранжевая
· рН = 6 окраска лимонно-желтая
· рН = 7 окраска желто-зеленая
· рН = 8 окраска зеленая
· рН = 9 окраска сине-зеленая
· рН = 10 окраска фиолетовая
2. Электрометрический способ основан на измерении электродвижущей силы в гальваническом элементе, составленном из водородселективного электрода (обычно стеклянного) и электрода сравнения (обычно хлорсеребряного). Этот способ будет подробно рассмотрен в теме «Электрохимические методы исследования. Потенциометрия». Погрешность измерения рН этим способом составляет ±0,05 единиц рН.
Разбор типовых задач
1. Вычислить рН раствора уксусной кислоты с концентрацией 0,04 моль/л, если степень диссоциации равна 0,9.
Решение:
СН3СООН « СН3СОО- + Н+
[H+] = C × a = 0,04 × 0,9 = 0,036 моль/л.
рН = -lg[Н+] = -lg3,6×10-2 = 2 – 0,56 = 1,44
2. Смешали два раствора: НС1 объемом 50 мл с концентрацией 0,2 моль/л и NaOH объемом 75 мл с концентрацией 0,15 моль/л. Вычислите рН полученного раствора.
Решение: При смешивании кислоты и щелочи идет реакция нейтрализации:
HCl + NaOH = NaCl + H2O
Рассчитаем моли каждого вещества: nHCl = 0,2 × 50 = 10 ммоль,
nNaOH = 0,15 × 75 = 11,25 ммоль.
NaOH находится в избытке, следовательно, среда будет щелочной.
nNaOH = 11,25 – 10 = 1,25 ммоль.
Концентрация NaOH в полученном растворе будет:
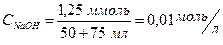 .
.
рН = 14 + lgCNaOH = 14 + lg0,01 = 14 – 2 = 12.
3. Как изменится рН, если в 1 л дистиллированной воды внести 0,01 моль NH4Cl?
Решение: рН дистиллированной воды равен 7. При растворении NH4Cl происходит обратимый гидролиз соли по катиону:
NH4Cl + H2O « NH4OH + HCl или
NH 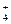 + H2O « NH4OH + H+
+ H2O « NH4OH + H+
Среда становится более кислой.
При гидролизе по катиону расчет рН ведем по формуле:
рН = 7 – 0,5рК 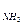 - 0,5lgC
- 0,5lgC 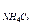
Из таблицы находим рК 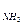 = 4,75.
= 4,75.
рН = 7 – 0,5 × 4,75 – 0,5lg0,01 = 7 – 2,375 + 1 » 5,6.
Итак, рН измениться от 7 до 5,6, т.е. на DрН = 7 – 5,6 = 1,4 единиц.
4. Оцените рН раствора, полученного растворением 0,53 г Na2CO3 в 10 л воды.
Решение: Найдем концентрацию Na2CO3 в полученном растворе:
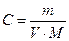 , где
, где
М 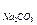 =106 г/моль
=106 г/моль
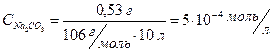
Гидролиз Na2CО3 протекает в 2 стадии:
Na2CО3 + H2O « NaHCO3 + NaOH
NaHCO3 + H2O « NaOH + H2CO3
Т.к., рК1 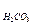 >>рК2
>>рК2 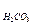 , учтем только первую стадию гидролиза.
, учтем только первую стадию гидролиза.
рН = 7 + 0,5рК2 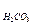 + 0,5lgС
+ 0,5lgС 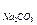
Из таблицы найдем рК2 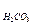 =10,33.
=10,33.
рН = 7 + 0,5 × 10,33 + 0,5lg5×10-4 = 7 + 5,165 – 0,5 × 3,3 = 10,5.
5. Вычислите константу и степень гидролиза СН3СООNH4 и рН этого раствора.
Решение: Гидролиз СН3СООNH4 идет одновременно по катиону и по аниону.
CH3COONH4 + H2O « CH3COOH + NH4OH
Константа гидролиза рассчитывается по формуле:
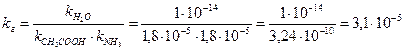
Степень гидролиза в этом случае рассчитывается по формуле:
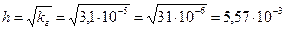
рН рассчитываем по формуле:
рН = 7 + 0,5рК 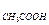 - 0,5рК
- 0,5рК 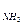 = 7 + 0,5 × 4,75 – 0,5 × 4,75 = 7.
= 7 + 0,5 × 4,75 – 0,5 × 4,75 = 7.
Лабораторная работа
Задание 1. Определение рН водных растворов слабых и сильных кислот и оснований колориметрическим способом (при помощи универсальной индикаторной бумаги).
В 5 пробирок внесите по 5 мл растворов HCl, NaOH, KNO3, CH3COOH и NH3. В каждую из них опустите полоску универсальной индикаторной бумаги и сравнивая окраску бумаги со шкалой запишите значение рН каждого раствора. Пользуясь соответствующими расчетными формулами рассчитайте рН этих растворов и сравните экспериментально определенные значения с расчетными.
Задание 2. Определение рН в водных растворах солей.
В шесть пробирок внесите по 5 мл растворов Na2CO3, NH4Cl, Na2SO4, KNO3, CH3COONa и дистиллированный воды. В каждую пробирку опустите по полоске универсальной индикаторной бумаги и сравнивая со шкалой запишите значения рН всех растворов. Для растворов Na2CO3 и CH3COONa добавьте по 2 капли раствора фенолфталеина, а в раствор NH4Cl еще опустите синюю лакмусовую бумагу. Свои наблюдения занесите в протокол лабораторной работы. В каких случаях происходил гидролиз солей? Напишите молекулярные и ионные уравнения гидролиза соответствующих солей, в случае Na2CO3 покажите ступенчатый гидролиз этой соли. Для солей NH4Cl, CH3COONa и Na2CO3 (по первой ступени) рассчитайте рН гидролиза этих солей в воде, и сравнивая значения рассчитанных величин с экспериментально определенными, сделайте выводы.
Задание 3. Изучение влияния температуры на степень гидролиза солей.
В пробирку налейте 5 мл раствора CH3COONa и добавьте 2 капли раствора фенолфталеина. Пользуясь держалкой нагрейте содержимое пробирки на пламени спиртовки. Наблюдайте за изменением интенсивности окраски индикатора. Затем содержимое пробирки охладите под струей холодной воды. Что происходит? Сделайте вывод о влиянии температуры на степень гидролиза этой соли. Рассчитайте степень и константу гидролиза СН3СООNa, пользуясь табличными значениями k 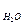 и k
и k 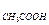 .
.
Задание 4. Изучение совместного гидролиза солей.
В одну пробирку налейте 3 мл раствора Al2(SO4)3, в другую – 3 мл раствора Na2CO3. Соедините содержимое двух пробирок и внимательно следите за изменениями в пробирке. Какой газ, и какой осадок выделяются в ходе реакции? Напишите молекулярное и ионное уравнения реакций совместного гидролиза этих солей. Почему в этом случае гидролиз приобретает необратимый характер? Полученный осадок разделите на 2 части: в одну добавьте раствор NaOH, в другую раствор НС1. Почему в обоих случаях осадок растворяется? Напишите молекулярные и ионные уравнения растворения Al(OH)3 в NaOH и HCl.
Ситуационные задачи для контроля усвоения темы
1. На примерах гидролиза AlCl3 и Al2S3 покажите различие в реакциях гидролиза этих солей.
2. Оцените, какую среду создают водные растворы солей: K2SO3, CrCl3, NaCl, CH3COONH4. При помощи молекулярных и ионных уравнений покажите создаваемую среду в случаях гидролиза.
3. Пользуясь знаниями по теме: «Химическая термодинамика» объясните биологическую роль гидролиза АТФ в организме.
4. Рассчитайте степень диссоциации 0,01 М и 0,0001 М растворов Н2SO3 по первом ступени пользуясь соответствующими значениями констант диссоциации.
5. Как изменится рН 0,01 М раствора NH3 при разбавлении в 10 раз?
6. Раствор HNO2 имеет значение рН=3,0. Пользуясь соответствующей формулой и константой диссоциации HNO2, рассчитайте концентрацию кислоты.
7. Оцените константу, степень гидролиза и рН полученного раствора при растворении 0,2 моль Na2S в 2 л воды по первой ступени.
8. Какой из электролитов имеет максимальную, а какой – минимальную степень ионизации, при условии, что каждый из них находится в растворе с концентрацией 0,01 моль/л: а) HCN; б) NH3; в) CH3COOH; г) HNO3; д) Na2HPO4.
9. В какой последовательности уменьшаются значения рН водных растворов с одинаковой концентрацией для следующих веществ: а) HF; б) CH3COOH; в) HCN; г) HCl; д) NH3.
10. Какая из 3-х солей будет подвергаться гидролизу в большей степени (при прочих равных условиях): сульфит натрия, сульфид калия, карбонат цезия по первой ступени. Ответ обоснуйте расчетом.
Домашнее задание
Тема: «Протолитические процессы в буферных растворах».
Литература: [1] с. 108; [3] с. 130; [4] с. 41.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАНЯТИЕ №11 | | | ЗАНЯТИЕ №13 |
Дата добавления: 2014-09-10; просмотров: 675; Нарушение авторских прав

Мы поможем в написании ваших работ!