
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЗАНЯТИЕ №13
Тема: Протолитические процессы в буферных растворах.
Актуальность темы: В результате жизнедеятельности в организме ежесуточно образуется большое количество кислот. Во-первых, при усвоении белков, жиров и углеводов образуется углекислота, ежесуточно – 13 моль. Помимо угольной кислоты образуются другие органические и минеральные кислоты, при смешанной диете – до 100 ммоль эквивалента. Например, при усвоении 100 г белка выделяется 60 ммоль эквивалента серной кислоты.
Образование кислот характерно для некоторых патологических процессов. При диабетическом кетозе образуется до 1 моль эквивалента ацетоуксусной и b-оксимасляной кислот. Кислоты в организме образуются и в результате приема внутрь некоторых лекарственных препаратов.
Все выделяющиеся кислоты утилизируются тем или иным способом: кислотные остатки фосфорной кислоты образуют органические фосфаты и входят в состав буферных систем крови и тканей, избыток выводится с мочой. Сульфат-ион образует сложные эфиры, которые выводятся почками. Молочная кислота либо окисляется до СО2, либо превращается в гликоген.
Физико-химические расчеты показывают, что 0,15 моль СО2 достаточно для того, чтобы нарушить кислотно-основное равновесие организма человека массой 75 кг. Однако в норме организм способен утилизировать до 13 моль выделяющегося ежесуточно СО2 без нарушения кислотно-основного равновесия. В этом наряду с физиологическими механизмами важную роль играют физико-химические механизмы. Среди последних важное значение имеет буферное действие, которое обеспечивается такими буферными системами, как гидрокарбонатная, гемоглобиновая, фосфатная и белковая. При нарушении кислотно-основного равновесия в организме уже через 10-15 минут включается буферная компенсация, которая затем подключает почечную и легочную компенсацию.
Учебные цели: ознакомиться приготовлением и определением емкости буферных растворов как систем, обеспечивающих кислотно-основный гомеостаз в живых организмах.
В результате освоения темы студент должен уметь:
· Отличать буферные системы от других систем;
· Показывать механизм буферного действия;
· Рассчитывать рН буферных систем, буферную емкость и соотношение компонентов в буферных растворах;
· Готовить простейшие буферные растворы и определять их буферную емкость по кислоте и по щелочи.
Для формирования умений студент должен знать:
· Протолитическую теорию кислот и оснований;
· Протолитические процессы в буферных растворах и механизм буферного действия;
· Расчетные формулы Гендерсона-Гассельбаха для оценки рН буферных растворов и буферной емкости;
· Значение буферных систем в жизнедеятельности и важнейшие буферные системы организма человека.
Вид занятий: лабораторно-практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: штатив с пробирками, мерные пипетки, мерная пробирка, бюретка на 25 мл, калькулятор, таблица физико-химических величин, коническая колба.
Реактивы: 0,1 моль/л растворы NaOH, HCI, CH3COOH и СН3СООNa, индикаторы метиловый красный и метиловый оранжевый, дистиллированная вода.
Содержание занятия
1. Контроль исходного уровня знаний (тест).
2. Разбор теоретических вопросов и решение типовых задач.
3. Выполнение лабораторной работы;
а) приготовление ацетатного буфера и оценка рН этих растворов;
б) влияние разбавления на значение рН раствора;
в) определение буферной емкости для ацетатного буфера по кислоте и по щелочи.
4. Проверка протоколов лабораторных работ.
5. Выходной контроль по решению ситуационных задач
6. Задание на дом: «Рубежная контрольная работа по блоку III».
Вопросы для подготовки к занятию
1. Дайте определение буферных растворов и их классификацию.
2. Как можно приготовить буферные растворы?
3. В чем механизм буферного действия? Покажите это на примерах ацетатного и фосфатного буферов.
4. Как рассчитывают рН буферных растворов различных типов по уравнениям Гендерсона-Гассельбаха?
5. От каких факторов зависит рН буферных растворов?
6. Что такое зона буферного действия? Как ее оценивают?
7. Что такое буферная емкость? Как ее рассчитывают по кислоте и по щелочи?
8. От чего зависит буферная емкость?
9. Какие буферные системы содержатся в организме человека? Какая из них обладает наибольшей буферной емкостью?
10. Какие механизмы обеспечивают постоянство рН биосред организма?
11. Какие пары образуют буферные растворы:
а) 50 мл 0,1 М NaOH и 20 мл 0,2 М СН3СООН
б) 50 мл 0,1 М H2SO4 и 100 мл 0,05 М NaOH
в) 50 мл 0,1 М НС1 и 40 мл 0,1 М CH3COONa
г) 20 мл 0,1 М CH3COONa и 30 мл 0,1 М СН3СООН
12. При определении альбумина по реакции с бромкрезоловым зеленым применяют ацетатный буфер. Уксусную кислоту объемом 50 мл смешивают с 13,2 мл раствора гидроксида натрия (концентрация каждого раствора равна 1 моль/л) и объем доводят дистиллированной водой до 1 литра. Вычислите рН используемого раствора.
13. Рассчитайте молярное соотношение компонентов буферной системы, содержащей аммиак и хлорид аммония, имеющей рН=9,8, если рК 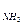 =4,75.
=4,75.
14. Как изменится рН фосфатного буфера, содержащего 12 мл 0,05 М гидрофосфата натрия и 8 мл 0,05 М дигидрофосфата натрия, после добавления 2 мл 0,05 М раствора NaOH?
Литература:
[1] с. 108; [3] с. 130; [4] с. 41.
Дополнительная:
1. Лекционный материал.
2. Ахметов Н.С. Общая и неорганическая химия. -М., Высшая школа. 2002.
Образец билета входного тест-контроля
1. Буферными системами являются смеси:
А) NaOH и H2SO4 Б) CH3COONa и NaOH
В) HCOOH и HCOONa Г) NaCl и HCl
Д) NaH2PO4 и K2HPO4
Ответ: В,Д.
2. рН аммонийного буфера рассчитывают по формуле:
А) 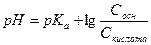 Б)
Б) 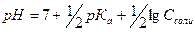
В) 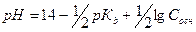 Г)
Г) 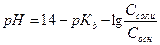
Д) 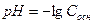
Ответ: Г.
3. Фосфатный буфер способен поддерживать рН в интервале:
А) 2,4 ¸ 3,7 Б) 6,4 ¸ 8,4 В) 8 ¸ 10
Г) 3,75 ¸ 5,75 Д) 1 ¸ 10
Ответ: Б.
4. Максимальная буферная емкость наблюдается при соотношении Ссопр.осн.: Скисл.:
А) 1:1 Б) 1:10 В) 10:1 Г) 2:8 Д) 5:10
Ответ: А.
5. Для развития бактерий пневмококка наиболее благоприятны значения рН:
А) 7,0 ¸ 7,4 Б) 7,4 В) 7,6 ¸ 7,8
Г) 0,9 Д) 5,4 ¸ 6,9
Ответ: В.
6. Наибольшая буферная емкость по кислоте у следующего буфера крови:
А) белковый Б) фосфатный В) аминокислотный
Г) аммонийный Д) гидрокарбонатный
Ответ: Д.
Информационная часть
Буферной системой называют равновесную систему, способную поддерживать примерно на постоянном уровне какой-либо параметр при незначительных внешних воздействиях. Протолитические буферные системы поддерживают рН при добавлении небольших количеств кислот и оснований или при разбавлении. Протолитические буферные системы состоят из слабой кислоты и избытка сопряженного с ней основания (1-ый тип) или слабого основания и избытка сопряженной с ним кислоты (2-ой тип).
Важным является то, что концентрация этих кислот на несколько порядков превышает концентрацию Н3О+ и ОН-.
1-ый тип 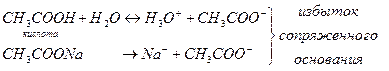
2-ой тип 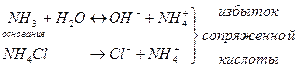
Раствор, содержащий одну или несколько буферных систем, называется буферным раствором.
Буферные растворы можно приготовить двумя способами:
· Частичной нейтрализацией слабого электролита сильным
СН3СООНизбыток + NaOH или NH3 избыток + HCl
· Смешивание растворов слабых электролитов с их солями (или двух солей):
СН3СООН + СН3СООNa или NH3 + NH4Cl или NaH2PO4 + Na2HPO4
Чтобы понять механизм буферного действия рассмотрим равновесие – ионизацию слабой кислоты в водном растворе:
НВ + Н2О « Н3О+ + В-
В соответствии с принципом смещения химического равновесия добавление в эту систему сильной кислоты или соли, содержащей анионы В- приведет к смещению равновесия влево, а при добавлении щелочи (ОН-) – вправо.
Если рассмотреть другое изолированное равновесие – гидролиз соли по аниону:
В- + Н2О « НВ + ОН-,
то аналогично, добавление щелочи или слабой кислоты сместит равновесие влево, а сильной кислоты – вправо.
При совмещении этих двух изолированных равновесий оказывается, что процессы, которые в них будут протекать при воздействии одних и тех же внешних факторов – добавлении Н3О+ и ОН- - разнонаправлены. Кроме того, концентрация одного из продуктов каждой из совмещаемых реакций влияет на положение равновесия другой реакции. Это и является причиной буферного действия. Иначе, протолитическая буферная система представляет собой совмещенное равновесие ионизации и гидролиза.
Уравнение буферной системы – уравнение, выражающее зависимость рН буферного раствора от состава буферной системы.
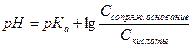
Для ацетатного буфера:
Ссопряж. основания = С 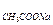
Скислоты = С 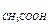
Для фосфатного буфера, состоящего из гидрофосфат- и дигидрофосфат-ионов:
Ссопряж. основания = С 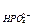
Скислоты = С 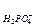
Как видно из приведенного уравнения, рН буферного раствора зависит от:
· природы слабого электролита;
· температуры (от нее зависит величина рКа);
· соотношения концентраций компонентов.
Буферное действие сохраняется в определенном интервале значений рН (зона буферного действия) и зависит от соотношения концентраций компонентов буферной системы. Установлено, что выраженное буферное действие наблюдается, если концентрация одного из компонентов превышает другую не более, чем в 10 раз.
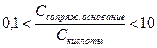 , т.е. рН = рКа±1
, т.е. рН = рКа±1
Иначе, имея в распоряжении кислоту с рКа, можно приготовить буферные растворы, поддерживающие значения рН в диапазоне от рКа -1 до рКа +1.
Количественно буферное действие характеризуется буферной емкостью. Буферная емкость (В) равна количеству вещества эквивалента сильной кислоты или сильного основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН на единицу. Различают буферную емкость по кислоте Ва и буферную емкость по основанию Вb.
Экспериментально буферную емкость можно определить титрованием буферной системы с последующим расчетом по уравнению:
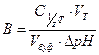 , где
, где
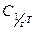 - молярная концентрация эквивалента титранта (НС1 или NaOH);
- молярная концентрация эквивалента титранта (НС1 или NaOH);
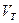 - объем титранта;
- объем титранта;
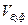 - объем буферного раствора, взятый для титрования
- объем буферного раствора, взятый для титрования
Буферная емкость будет тем больше, чем больше суммарная концентрация компонентов буферного раствора при постоянном соотношении их концентраций. Максимальная буферная емкость будет наблюдаться при соотношении Ссопряж. основание : Скислоты= 1.
Несмотря на то, что в процессе метаболизма в организме постоянно образуются кислоты, рН тканей и биохимических жидкостей поддерживается примерно постоянным. В таблицах приведены значения рН различных систем и наиболее благоприятные значения рН среды для развития патогенных бактерий.
Значение рН различных систем
| Среды организма | рН |
| Сыворотка крови | 7,36-7,44 |
| Чистый желудочный сок | 0,9 |
| Сок поджелудочной железы | 7,5-7,8 |
| Желчь в протоках | 7,4-8,5 |
| Желчь в пузыре | 5,4-6,9 |
| Моча | 4,8-7,5 |
| Молоко | 6,6-6,9 |
| Дистиллированная вода, находящаяся в равновесии с воздухом | 5,5 |
| Морская вода | 8,0 |
| Свежий яичный белок | 8,0 |
Значение рН, благоприятные для развития патогенных бактерий
| Вид бактерий | рН |
| Стафилококки | 7,4 |
| Стрептококки | 7,4-76 |
| Пневмококки | 7,6-7,8 |
| Менингококки | 7,4-7,6 |
| Гонококки | 7,0-7,4 |
В организме человека присутствуют различные буферные системы. Из них наиболее важными являются: гидрокарбонатная, гемоглобиновая, фосфатная и белковая.
Гидрокарбонатная система образована оксидом углерода (IV) (как кислота) и гидрокарбонат-ионом (как сопряженное основание). Для гидрокарбонатного буфера рН рассчитывают по формуле:
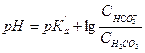
Это уравнение носит название уравнения Гендерсона-Гассельбаха. Значение рК 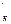 для данного уравнения отличается от справочной величины рКа для Н2СО3, и равно 6,1.
для данного уравнения отличается от справочной величины рКа для Н2СО3, и равно 6,1.
С учетом коэффициента растворимости СО2 получим другую форму уравнения Гендерсона-Гассельбаха:
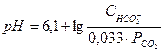 , где
, где
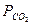 - парциальное давление СО2.
- парциальное давление СО2.
В организме протекает обратимая реакция:
СО2 + Н2О « Н2СО3 « Н+ + НСО 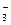
Она ускоряется ферментом карбоангидразой. Изменение концентрации любой составной части этого буфера приводит к смещению равновесия и соотношение концентраций остается постоянным. Буферная емкость гидрокарбонатного буфера по кислоте значительно выше, чем буферная емкость по основанию. Поэтому главное назначение этого буфера в нейтрализации кислот.
Гидрокарбонатный буфер является основной буферной системой плазмы крови и является системой быстрого реагирования, т.к. продукт его взаимодействия с кислотами – СО2 быстро выводится через легкие. Гидрокарбонатный буфер также содержится в эритроцитах, почечной ткани и интерстициальной жидкости.
Гемоглобиновая буферная система представлена двумя слабыми кислотами – гемоглобином и оксигемоглобином – и сопряженными им основаниями, соответственно гемоглобинат- и оксигемоглобинат-ионами:
ННb « H+ + Hb-
кислота основание
HHbO2 « H+ + HbO 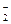
Гемоглобиновый буфер является буферной системой эритроцитов. Оксигемоглобин – более сильная кислота (рКа=6,95), чем гемоглобин (рКа=8,20). Поэтому присоединение кислорода к гемоглобину понижает рН крови. С другой стороны, при отдаче кислорода в тканях рН крови вновь возрастает.
Фосфатная буферная система функционирует в основном в плазме. Она представлена ионами Н2РО 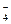 (кислота) и НРО
(кислота) и НРО  (основание). Фосфатная буферная система более консервативна, т.к. избыточные продукты нейтрализации выводятся через почки.
(основание). Фосфатная буферная система более консервативна, т.к. избыточные продукты нейтрализации выводятся через почки.
В организме также функционируют:
· белковая или протеиновая;
· аминокислотная;
· аммиачная (в почках) буферные системы.
Разбор типовых задач
1. Вычислите рН фосфатного буфера, составленного 100 мл 0,1 М КН2РО4 и 50 мл 0,15 М К2НРО4.
Решение: Расчет рН фосфатного буфера проводим по формуле:
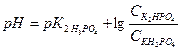
Значение 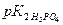 = 6,8 (берем из справочника).
= 6,8 (берем из справочника).
Так как концентрация вещества пропорциональна количеству вещества:
n = C×V,
то в формулу подставим количества вещества КН2РО4 и К2НРО4.
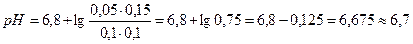
2. При смешении 10 мл 0,1 М формиата натрия с 5 мл 0,05 М раствора НС1 был получен формиатный буфер. Рассчитайте значение рН этого раствора.
Решение: При смешении этих растворов протекает реакция:
HCOONa + HCl = HCOOH + NaCl
Из расчета количества вещества видно, что HCOONa в избытке.
nHCOONa = 0,01×0,1 = 0,001 моль
nНС1 = 0,005×0,05 = 0,00025 моль
После реакции формиата натрия останется:
nHCOONa = 0,001 - 0,00025 = 0,00075 моль
Вместе с образовавшейся муравьиной кислотой формиат натрия образует формиатный буфер nHCOOН = nНС1 = 0,00025 моль.
Расчет рН ведем по формуле:
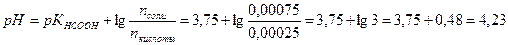
Здесь учли, что рКНСООН = 3,75.
3. Как изменится рН фосфатного буфера, содержащего 100 мл дигидрофосфата калия и 300 мл раствора гидрофосфата калия (концентрации исходных растворов равны по 0,1 моль/л), при добавлении к нему 20 мл раствора NaOH с концентрацией 0,1 моль/л?
Решение: Сначала рассчитаем значение рН исходного раствора:
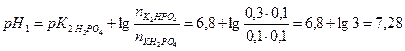
При добавлении NaOH с ним в первую очередь взаимодействует КН2РО4 по схеме:
КН2РО4 + NaOH = NaKHPO4 + H2O
Часть дигидрофосфата переходит в гидрофосфат.
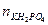 = 0,1×0,1 = 0,01 моль;
= 0,1×0,1 = 0,01 моль; 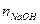 = 0,02×0,1 = 0,002 моль
= 0,02×0,1 = 0,002 моль
После реакции дигидрофосфата калия останется:
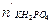 = 0,01 - 0,002 = 0,008 моль
= 0,01 - 0,002 = 0,008 моль
Общее количество гидрофосфата станет:
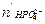 = 0,3 × 0,1 + 0,002 = 0,032 моль
= 0,3 × 0,1 + 0,002 = 0,032 моль
Рассчитаем рН полученного раствора:
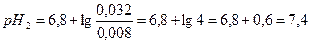
Изменение рН составит:
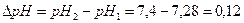
4. В каком мольном соотношении надо смешать аммиак и хлорид аммония, чтобы получить буферный раствор с рН = 9,0, если рК 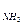 =4,75?
=4,75?
Решение: Расчет рН аммонийного буфера проводят по формуле:
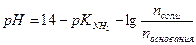
Подставляя значения рН и рК 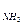 получим:
получим:
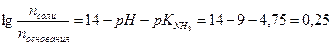
Тогда:
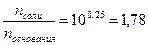
Следовательно, мольное соотношение NH4Cl к NH3 должно быть:
n 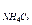 : n
: n 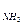 ® 1,78 : 1
® 1,78 : 1
5. К 100 мл крови для изменения рН от 7,36 до 7,00 надо дабавить 3,6 мл соляной кислоты с концентрацией 0,1 моль/л. Какова буферная емкость крови по кислоте?
Решение: Расчет буферной емкости по кислоте проводят по формуле:
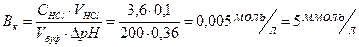
Лабораторная работа
Задание 1. Приготовление буферного раствора.
В три пробирки внесите 0,1 М растворы СН3СООН и СН3СООNa в соотношении (по объему): 9:1, 5:5 и 1:9. Каждый приготовленный раствор хорошо перемешать. Во все три пробирки прибавьте по 3 капли индикатора метилового оранжевого или метилового красного. Сравните и запишите окраску растворов. По известной формуле рассчитайте значения рН во всех трех растворах. В каких пределах изменилось значение рН?
Задание 2. Влияние разбавления на рН буферных растворов.
Приготовьте 3 раствора ацетатного буфера в соотношении 9:1, 5:5 и 1:9 как в предыдущем опыте. Затем в 3 чистые пробирки отберите по 2 мл приготовленных буферных растворов и добавьте в каждую из них по 8 мл дистиллированной воды. Растворы хорошо перемешайте. Во вновь приготовленные растворы (с разбавлением) добавьте по 3 капли индикатора метилового красного как и в первом случае. Сравните окраски растворов между собой и с первыми тремя пробирками. Сделайте заключение по окраске содержимого пробирок. С учетом разбавления исходных растворов вновь рассчитайте значения рН полученных растворов. Результаты наблюдений и расчетов внесите в таблицу по форме и сделайте выводы.
| Номера пробирок | ||||||
| Соотношение кислота : соль в буферном растворе | ||||||
| Окраска растворов после добавления индикатора | ||||||
| Расчетное значение рН |
Задание 3. Определение буферной емкости по кислоте и по щелочи.
В конической колбе приготовьте буферный раствор, смешав 10 мл 0,1 М СН3СООН и 10 мл 0,1 М раствора СН3СООNa. В другой колбе приготовьте раствор – свидетель, смешивая 18 мл 0,1 М СН3СООН и 2 мл 0,1 М СН3СООNa.
В обе колбы внесите по 3 капли раствора метилового оранжевого. Сравните окраску растворов. Затем содержимое первой колбы титруйте из бюретки 0,1 М раствором НС1 до получения одинаковой окраски с раствором – свидетелем. Запишите затраченный объем раствора НС1 и рассчитайте по известной формуле буферную емкость ацетатного буфера. Значение рН содержимого 1 и 2 колб берите из расчетных величин 2 и 3 пробирок (см. табл. из пред. задания). Бюретку с 0,1 М раствором НС1 надо приготовить соблюдая правила ацидометрии параллельно с приготовлением содержимого 1 и 2 колб.
Для определения емкости ацетатного буфера по щелочи надо приготовить колбу с содержанием 10 мл 0,1 М СН3СООН и 10 мл 0,1 М СН3СООNa и раствор – свидетель (другая колба), содержащий 18 мл 0,1 М СН3СООNa и 2 мл 0,1 М СН3СООН. После добавления 3 капель раствора метилового оранжевого в каждую колбу, содержимое 1-ой колбы титруйте из бюретки 0,1 М раствором NaOH до одинаковой окраски с раствором – свидетелем. Записав объем затраченного раствора NaOH рассчитайте буферную емкость по щелочи. Значения рН содержимого 1-ой и 2-ой колб берите из расчетных величин 2 и 1 пробирок (см. табл. из пред. задания). Бюретку с 0,1 М раствором NaOH надо приготовить соблюдая правила алкалиметрии параллельно с приготовлением содержимого 1-ой и 2-ой колб.
Сравните буферную емкость ацетатного буфера по кислоте и по щелочи. Сделайте выводы.
Ситуационные задачи для контроля усвоения темы
1. Океанская вода ведет себя как буферный раствор при поступлении в нее щелочных или кислых вод. Опишите процессы, протекающие при этом, учитывая, что в воздухе, контактирующем с водой, содержится углекислый газ, а в морских осадках карбонаты кальция и магния.
2. Будут ли образовываться буферные растворы при смешении следующих растворов: а) 10 мл 0,1 М HCOONa и 5 мл 0,1 М НС1, б) 10 мл 0,1 М HCOONa и 5 мл 0,1 М NaOH, в) 10 мл 0,1 М NH3 и 5 мл 0,1 М NH4Cl, г) 10 мл 0,1 М NH3 и 20 мл 0,05М НС1? Ответ подтвердите расчетами. В случае образования буферных растворов рассчитайте значение рН образовавшихся буферов.
3. Имеется 250 мл раствора аммиака с рН=11. Какую массу нитрата аммония следует растворить в этом растворе для получения буфера с рН=9,0?
4. В качестве консерванта пищевых продуктов часто применяют бензоат натрия. Вычислите отношение концентраций бензоат-иона и бензойной кислоты: а) в желудочном содержимом (рН=0,9), б) в содержимом кишечника (рН=7,5). Принять, что рН биосред в норме и рК  =4,2.
=4,2.
5. Какое максимальное и минимальное количество НСООН можно добавить к КОН массой 5,6 г, чтобы после растворения смеси в воде получился буферный раствор?
6. Буферная емкость раствора по кислоте равна 40 ммоль/л. Вычислите, какой объем 0,2 моль/л НС1 можно добавить к 100 мл этого раствора, чтобы сместить рН на 0,4 единиц.
7. В пяти колбах содержатся по 20 мл раствора NH3 с концентрацией 0,05 моль/л. В каждую из этих колб добавлена НС1 с концентрацией 0,1 моль/л в разных объемах: а) 0,5 мл; б) 5 мл; в) 7,5 мл; г) 10 мл; д) 15 мл. Какие из образовавшихся растворов обладают буферным действием? Ответ подтвердите расчетами. Для буферных растворов рассчитайте значение рН.
8. Чему равно соотношение концентраций компонентов ацетатного буфера в растворе с концентрацией: а) гидроксид-ионов, равной 2×10-9 моль/л; б) ионов водород, равной 1×10-5 моль/л?
9. Имеется раствор аммиака с рН=11,0 и раствор хлорида аммония с рН 5,6. Вычислите рН раствора, который получится смешением равных объемов этих растворов.
10. При исследованиях осмотической стойкости эритроцитов в клинической лаборатории применяют фосфатный буфер, который готовят следующим образом: безводный гидрофосфат натрия массой 27,31 г, дигидрат дигидрофосфата натрия массой 4,86 г и хлорид натрия массой 180 г растворяют в воде, после чего объем раствора доводят до 2 л. Вычислите рН такого буферного раствора. Объясните значение NaCl в этом растворе.
11. К 200 мл крови для изменения рН на 0,36 надо добавить 26 мл 0,01 М раствора НС1. Какова буферная емкость крови по кислоте?
12. Буферная емкость раствора по основанию равна 45 ммоль/л. Вычислите, какой объем раствора NaOH с концентрацией 0,1 моль/л можно добавить к 250 мл этого буфера, чтобы сместить рН не более чем на 0,3 единицы?
13. Пользуясь уравнением Гендерсона-Гассельбаха рассчитайте парциальное давление углекислого газа в крови, если при ацидозе рН понижается до 7,0. Концентрацию гидрокарбонат-ионов принять равной 0,05 моль/л.
14. Во сколько раз масса гидрофосфата калия была больше массы дигидрофосфата натрия, если рН полученного буферного раствора на 0,5 единиц больше силового показателя дигидрофосфат-иона (7,2)?
Домашнее задание
Тема: «Рубежная контрольная работа по блоку III».
Литература: [1] с. 66, 80; [3] с. 105, 130; [4] с. 52.
Дополнительная: лекционный материал.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАНЯТИЕ №12 | | | ЗАНЯТИЕ №14 |
Дата добавления: 2014-09-10; просмотров: 1996; Нарушение авторских прав

Мы поможем в написании ваших работ!