
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЗАНЯТИЕ №14
Тема: Рубежная контрольная работа по III блоку.
Учебные цели: проверка усвоения материала по данному блоку.
Вид занятий: практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: справочники, калькуляторы, таблицы.
Содержание занятия
1. Решение ситуационных и расчетных задач.
2. Ответы на теоретические вопросы.
3. Защита одной из лабораторных работ
4. Подведение итогов занятия. Задание на дом по теме: «Гетерогенные равновесия и процессы».
Вопросы к рубежной контрольной работе по III блоку
1. Что понимают под термином «коллигативные свойства растворов»? Какие это свойства?
2. Что такое идеальный раствор? К каким растворам применим данный термин приближенно?
3. Какие формулировки закона Ф.М. Рауля вы знаете? Какова их математическая форма записи?
4. Какие два следствия вытекают из закона Рауля? Их формулировки и математическая форма записи? Для каких систем их можно применить?
5. Что называется температурой кипения? Температурой замерзания (плавления)? Депрессией? Повышением температуры кипения?
6. Каков физический смысл эбуллиоскопической и криоскопической констант? От каких факторов они зависят? Единицы измерения?
7. Что называют осмосом? Приведите примеры осмоса, имеющее место в природе.
8. Что такое осмотическое давление? Осмометрия?
9. Сформулируйте закон Я. Вант-Гоффа для осмотического давления. Его математическая форма записи?
10. Что называется изотоническим, гипер- и гипотоническим раствором? Что такое цитолиз (лизис) и плазмолиз?
11. В чем смысл изотонического коэффициента Вант-Гоффа? Как его можно определить экспериментально и как рассчитывают теоретически?
12. Что такое осмоляльность и осмолярность? Изоосмия? Какова ее роль в общем гомеостазе для организма человека?
13. Как подразделяется вещества по их способности проводить электрический ток?
14. Как делятся электролиты по их способности диссоциировать? Приведите примеры электролитов различной силы.
15. Что такое степень диссоциации? Какова ее размерность?
16. В чем сущность теории электролитической диссоциации С. Аррениуса?
17. Что такое «кислота» и «основание» по Аррениусу?
18. В чем роль растворителя в процессе диссоциации электролитов?
19. Какие факторы влияют на степень диссоциации? Каково их влияние?
20. В чем сущность закона разведение В. Оствальда? Его математическое выражение.
21. Что такое ступенчатая диссоциация и как связаны константы ступенчатых диссоциаций с общей константой диссоциации электролита? Показать на примерах.
22. Подчиняются ли сильные электролиты закону разведения Оствальда? Почему?
23. В чем сущность теории сильных электролитов Дебая-Хюккеля?
24. Что такое ионная сила? Коэффициент активности? Активность? Как их рассчитывают?
25. В каких случаях реакции между растворами электролитов идут практически до конца?
26. В чем сущность сокращенных ионных уравнений реакций?
27. Напишите уравнения реакции диссоциации следующих электролитов: сульфата меди (II), карбоната аммония, сульфата калия и хрома (III), дигидрофосфата натрия, гидроксосульфата алюминия, тетрагидроксоалюмината калия.
28. Между какими парами веществ возможны реакции:
а) K2CO3 + CaCI2;
б) AI(NO3)3+CrCI3;
в) MgSO4+Na3PO4;
г) CuCI2+K2SO4;
д) AICI3+NaOH.
В тех случаях, когда возможно протекание реакции, напишите уравнения реакций в молекулярном и ионном видах.
29. По данным сокращенным ионным уравнениям составьте ионно-молекулярные и молекулярные уравнения реакций:
а) Cr(OH)3 + 3H+ = Cr3+ + 3H2O;
б) Cr(OH)3 + 3OH- = [Cr(OH)6]3-;
в) 2CO 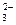 + 2Mg2+ + H2O = (MgOH)2CO3+CO2;
+ 2Mg2+ + H2O = (MgOH)2CO3+CO2;
г) Ca2+ + 2OH- = Ca(OH)2;
д) PO 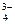 + 3H+ = H3PO4;
+ 3H+ = H3PO4;
е) 3Ca2+ + 2PO 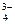 = Ca3(PO4)2.
= Ca3(PO4)2.
30. Закончите данные уравнения реакций:
а) CuSO4 + NH3 →
б) AI4C3 + H2O →
в) CrCI3 + K2S + H2O →
г) H3PO4 + NaOH →
д) Ca3(PO4)2 + H2SO4(конц) →
е) Cr2(SO4)3 + KOH →
Приведите молекулярно-ионные и сокращенные ионные уравнения реакций.
31. В чем принципиальное различие теории кислот и оснований Бренстеда-Лоури от теории С. Аррениуса?
32. Понятия сопряженной кислоты и сопряженного основания.
33. Приведите примеры кислот и оснований:
а) молекулярные,
б) катионные,
в) анионные.
34. Приведите примеры 2-х амфолитов и их взаимодействия с кислотами и основаниями.
35. Что такое константа кислотности и константа основности? Как они связаны для водных растворов?
36. Выразите константы кислотности (ступенчатые и суммарные) для следующих кислот:
а) муравьиной,
б) сернистой,
в) ортоборной.
37. Выразите константы основности (ступенчатые и суммарные) для следующих оснований:
а) гидроксида аммония,
б) гидроксида магния,
в) гидроксида железа (III).
38. Расположите следующие кислоты в порядке возрастания их силы (пользуясь таблицей констант кислотности и основности): фтороводородная, фосфорная, азотная, сернистая, сероводородная, угольная, циановодородная. Для двух- и многоосновных кислот надо брать первые константы кислотности.
39. Покажите ступенчатый гидролиз солей:
а) карбоната калия,
б) хлорида аммония,
в) оксалата аммония.
Какими способами можно подавить гидролиз каждой соли?
40. Напишите молекулярные и ионные уравнения реакций взаимодействия водных растворов:
а) сульфата хрома (III) и карбоната калия,
б) хлорида алюминия и сульфида калия,
в) бромида магния и сульфита натрия.
41. Пользуясь таблицей констант кислотности и основности оцените реакцию среды, которая создается при растворении в воде следующих солей:
а) гидрокарбоната натрия,
б) хлорида марганца (II),
в) формиата аммония,
г) хлорида калия,
д) ацетата аммония.
42. Интервалы перехода окраски индикаторов:
· метилоранжа – от рН 3,1 до 4,4,
· фенолфталеина – от рН 8,0 до 10,0.
Какой из индикаторов будете использовать при титровании растворов:
а) уксусной кислоты гидроксидом натрия,
б) аммиака соляной кислотой,
в) азотной кислоты гидроксидом калия?
Дать обоснованный ответ.
43. Дайте определение буферных растворов и их классификацию.
44. Как можно приготовить буферные растворы?
45. В чем механизм буферного действия? Покажите это на примерах ацетатного и фосфатного буферов.
46. Как рассчитывают рН буферных растворов различных типов по уравнениям Гендерсона-Гассельбаха?
47. От каких факторов зависит рН буферных растворов?
48. Что такое зона буферного действия? Как ее оценивают?
49. Что такое буферная емкость? Как ее рассчитывают по кислоте и по щелочи?
50. От чего зависит буферная емкость?
51. Какие буферные системы содержатся в организме человека? Какая из них обладает наибольшей буферной емкостью?
52. Какие механизмы обеспечивают постоянство рН биосред организма?
53. Какие пары образуют буферные растворы:
а) 50 мл 0,1 М NaOH и 20 мл 0,2 М СН3СООН
б) 50 мл 0,1 М H2SO4 и 100 мл 0,05 М NaOH
в) 50 мл 0,1 М НС1 и 40 мл 0,1 М CH3COONa
г) 20 мл 0,1 М CH3COONa и 30 мл 0,1 М СН3СООН
Типовые задачи к рубежной контрольной работе по III блоку
1. Разбавленные растворы сахарозы и глюкозы имеют равные массовые доли воды. Какой из этих растворов будет кипеть при более высокой температуре? Ответ обосновать.
2. Как будет меняться во времени осмотическое давление раствора, в котором происходит ферментативный гидролиз дипептида? Ответ обосновать.
3. Водные растворы мочевины и сахарозы разделены полупроницаемой мембраной. Направленного переноса растворителя через мембрану не происходит. Какой их растворов имеет большее значение массовой доли растворенного вещества? Ответ обосновать.
4. Объясните, почему водный раствор мочевины кипит при температуре выше 100о С, а водный раствор этанола – при температуре ниже 100о С при равных массовых долях растворенных веществ?
5. Молярная концентрация мочевины в ее бензольном растворе равна молярной концентрации мочевины в ее водном растворе. Какой раствор – водный или бензольный – имеет большее значение величины депрессии? Ответ обосновать.
6. Выведите молекулярную формулу эритрозы, имеющей состав Сn(Н2О)n, если известно, что водный раствор, содержащий 10 г эритрозы в 1 кг воды, замерзает при -0,155о С.
7. Опишите поведение эритроцитов при 310о К в растворе мочевины с молярной концентрацией 0,3 моль/л.
8. У человека осмолярность интерстициальной жидкости повышается с 0,3 осмоль/л в корковом веществе до 1,2 осмоль/л в сосочке нефрона. Вычислите, как изменяется при этом осмотическое давление.
9. Плазме крови изотоничен раствор хлорида натрия с массовой долей 0,9%. Плотность этого раствора равна 1,005 г/мл. Вычислите изотонический коэффициент и степень диссоциации хлорида натрия в таком растворе.
10. Рассчитайте осмотическое давление, которое создает «Квартасоль» (плазмозамещающий раствор), при температуре 37о С, если принять степени диссоциации солей 0,8; 0,85; 0,75 и 0,9 в порядка их перечисления. Состав «Квартасоль»:
Натрия хлорид 0,475 г
Калия хлорид 0,15 г
Натрия ацетат 0,26 г
Натрия гидрокарбонат 0,1
Вода для инъекций до 100 мл
11. Даны водные растворы следующих веществ: бромид калия, нитрат хрома (III), гидроксид натрия, нитрат свинца (II), серная кислота, хлорид бария. Напишите возможные реакции между этими веществами в молекулярном и ионном видах и объясните, почему они протекают.
12. Какие пары веществ не могут вместе существовать: а) хромат калия и нитрат бария; б) серная кислота и хлорид бария; в) бромид железа (III) и нитрат кальция; г) иодид аммония и гидроксид калия; д) нитрат бария и хлорид калия? Ответ обоснуйте соответствующими уравнениями реакций в молекулярном и ионном видах.
13. Найти ионную силу раствора, содержащего 7,45 г KCl и 0,01 моль K2SO4 в 1 л раствора.
14. Уксусная кислота в 0,76% -ном растворе (плотность 1 г/мл) ионизирована на 0,19%. Вычислите константу ионизации.
15. Чему равны активности ионов Ca2+ и Cl- в 0,02 М растворе CaCl2?
16. Имеются два раствора с одинаковой молярной концентрацией: хлорид калия и сульфат магния. Какой из этих растворов имеет большее значение ионной силы? Дайте краткое пояснение.
17. Значения изотонического коэффициента некоторых электролитов при разбавлении водного раствора стремятся к: а)2; б)3; в)4. Приведите по 2 примера каждого типа электролитов.
18. Рассчитайте ионную силу плазмозамещающего раствора «Трисоль», который готовят по прописи:
· натрия хлорид 0,5 г
· калия хлорид 0,1 г
· натрия гидрокарбонат 0,4 г
· вода для инъекций до 100 мл
19. Водные растворы сульфата цинка с массовой долей 0,1%; 0,25% и 0,5% применяются в качестве глазных капель как антисептическое и вяжущее средства. Рассчитайте активность иона цинка в таких растворах. Плотность каждого раствора условно принять равной 1 г/мл.
20. При лечении маниакальных состояний препаратами лития (в виде LiCl) концентрация иона лития в плазме должна быть не ниже 0,6 ммоль/л и не выше 1,6 ммоль/л. Вычислите диапазон активностей иона лития в плазме.
21. На примерах гидролиза AlCl3 и Al2S3 покажите различие в реакциях гидролиза этих солей.
22. Оцените, какую среду создают водные растворы солей: K2SO3, CrCl3, NaCl, CH3COONH4. При помощи молекулярных и ионных уравнений покажите создаваемую среду в случаях гидролиза.
23. Пользуясь знаниями по теме: «Химическая термодинамика» объясните биологическую роль гидролиза АТФ в организме.
24. Рассчитайте степень диссоциации 0,01 М и 0,0001 М растворов Н2SO3 по первом ступени пользуясь соответствующими значениями констант диссоциации.
25. Как изменится рН 0,01 М раствора NH3 при разбавлении в 10 раз?
26. Раствор HNO2 имеет значение рН=3,0. Пользуясь соответствующей формулой и константой диссоциации HNO2, рассчитайте концентрацию кислоты.
27. Оцените константу, степень гидролиза и рН полученного раствора при растворении 0,2 моль Na2S в 2 л воды по первой ступени.
28. Какой из электролитов имеет максимальную, а какой – минимальную степень ионизации, при условии, что каждый из них находится в растворе с концентрацией 0,01 моль/л: а) HCN; б) NH3; в) CH3COOH; г) HNO3; д) Na2HPO4.
29. В какой последовательности уменьшаются значения рН водных растворов с одинаковой концентрацией для следующих веществ: а) HF; б) CH3COOH; в) HCN; г) HCl; д) NH3.
30. Какая из 3-х солей будет подвергаться гидролизу в большей степени (при прочих равных условиях): сульфит натрия, сульфид калия, карбонат цезия по первой ступени. Ответ обоснуйте расчетом.
31. Океанская вода ведет себя как буферный раствор при поступлении в нее щелочных или кислых вод. Опишите процессы, протекающие при этом, учитывая, что в воздухе, контактирующем с водой, содержится углекислый газ, а в морских осадках карбонаты кальция и магния.
32. Будут ли образовываться буферные растворы при смешении следующих растворов: а) 10 мл 0,1 М HCOONa и 5 мл 0,1 М НС1, б) 10 мл 0,1 М HCOONa и 5 мл 0,1 М NaOH, в) 10 мл 0,1 М NH3 и 5 мл 0,1 М NH4Cl, г) 10 мл 0,1 М NH3 и 20 мл 0,05М НС1? Ответ подтвердите расчетами. В случае образования буферных растворов рассчитайте значение рН образовавшихся буферов.
33. Имеется 250 мл раствора аммиака с рН=11. Какую массу нитрата аммония следует растворить в этом растворе для получения буфера с рН=9,0?
34. В качестве консерванта пищевых продуктов часто применяют бензоат натрия. Вычислите отношение концентраций бензоат-иона и бензойной кислоты: а) в желудочном содержимом (рН=0,9), б) в содержимом кишечника (рН=7,5). Принять, что рН биосред в норме и рК  =4,2.
=4,2.
35. Какое максимальное и минимальное количество НСООН можно добавить к КОН массой 5,6 г, чтобы после растворения смеси в воде получился буферный раствор?
36. Буферная емкость раствора по кислоте равна 40 ммоль/л. Вычислите, какой объем 0,2 моль/л НС1 можно добавить к 100 мл этого раствора, чтобы сместить рН на 0,4 единиц.
37. В пяти колбах содержатся по 20 мл раствора NH3 с концентрацией 0,05 моль/л. В каждую из этих колб добавлена НС1 с концентрацией 0,1 моль/л в разных объемах: а) 0,5 мл; б) 5 мл; в) 7,5 мл; г) 10 мл; д) 15 мл. Какие из образовавшихся растворов обладают буферным действием? Ответ подтвердите расчетами. Для буферных растворов рассчитайте значение рН.
38. Чему равно соотношение концентраций компонентов ацетатного буфера в растворе с концентрацией: а) гидроксид-ионов, равной 2×10-9 моль/л; б) ионов водород, равной 1×10-5 моль/л?
39. Имеется раствор аммиака с рН=11,0 и раствор хлорида аммония с рН 5,6. Вычислите рН раствора, который получится смешением равных объемов этих растворов.
40. При исследованиях осмотической стойкости эритроцитов в клинической лаборатории применяют фосфатный буфер, который готовят следующим образом: безводный гидрофосфат натрия массой 27,31 г, дигидрат дигидрофосфата натрия массой 4,86 г и хлорид натрия массой 180 г растворяют в воде, после чего объем раствора доводят до 2 л. Вычислите рН такого буферного раствора. Объясните значение NaCl в этом растворе.
41. К 200 мл крови для изменения рН на 0,36 надо добавить 26 мл 0,01 М раствора НС1. Какова буферная емкость крови по кислоте?
42. Буферная емкость раствора по основанию равна 45 ммоль/л. Вычислите, какой объем раствора NaOH с концентрацией 0,1 моль/л можно добавить к 250 мл этого буфера, чтобы сместить рН не более чем на 0,3 единицы?
43. Пользуясь уравнением Гендерсона-Гассельбаха рассчитайте парциальное давление углекислого газа в крови, если при ацидозе рН понижается до 7,0. Концентрацию гидрокарбонат-ионов принять равной 0,05 моль/л.
44. Во сколько раз масса гидрофосфата калия была больше массы дигидрофосфата натрия, если рН полученного буферного раствора на 0,5 больше силового показателя дигидрофосфат-иона (7,2)?
45. Вычислить осмотическое давление раствора при стандартных условиях, если в 100 мл этого раствора содержится 1∙1020 молекул растворенного неэлектролита.
46. При какой температуре замерзает раствор, содержащий 0,5 моль неэлектролита в 250 г воды?
47. При растворении 13,0 г неэлектролита в 400 г диэтилового эфира температура кипения повысилась на 0,453о К. Чему равна молекулярная масса растворенного вещества?
48. В равных количествах воды растворено в одном случае 0,5 моль сахарозы, а в другом 0,2 моль СаС12. Температуры замерзания обоих растворов одинаковы. Чему равна степень диссоциации СаС12?
49. При определении альбумина по реакции с бромкрезоловым зеленым применяют ацетатный буфер. Уксусную кислоту объемом 50 мл смешивают с 13,2 мл раствора гидроксида натрия (концентрация каждого раствора равна 1 моль/л) и объем доводят дистиллированной водой до 1 литра. Вычислите рН используемого раствора.
50. Рассчитайте молярное соотношение компонентов буферной системы, содержащей аммиак и хлорид аммония, имеющей рН=9,8, если рК 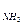 =4,75.
=4,75.
51. Как измениться рН фосфатного буфера, содержащего 12 мл 0,05 М гидрофосфата натрия и 8 мл 0,05 М дигидрофосфата натрия, после добавления 2 мл 0,05 М раствора NaOH?
Образец I части билета рубежного контроля по III блоку
1. В равных количествах воды растворено в одном случае 0,5 моль глюкозы, а в другом 0,2 моль СаС12. Температуры замерзания обоих растворов одинаковы. Чему равна степень диссоциации СаС12?
2. Пользуясь табличными значениями констант рассчитайте константу и степень гидролиза 0,01 М раствора KF и значение рН в этом растворе.
3. Буферная емкость раствора по кислоте равна 40 ммоль/л. Вычислите какой объем 0,2 моль/л НС1 можно добавить к 100 мл этого раствора, чтобы рН сместить на 0,4 единиц.
Образец II части билета рубежного контроля по III блоку
1. Протолитические процессы в растворах сильных и слабых кислот.
2. Фосфатный буфер. Механизм действия, расчет рН и буферной емкости. Значение фосфатного буфера в жизнедеятельности.
3. Защита лабораторной работы: «Влияние природы электролита и растворителя, концентрации и одноименного иона на степень диссоциации».
Домашнее задание
Тема: «Гетерогенные равновесия и процессы».
Литература: [1] с. 129; [3] с. 125; [4] с. 60.
Дополнительная: лекционный материал.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАНЯТИЕ №13 | | | ЗАНЯТИЕ №15 |
Дата добавления: 2014-09-10; просмотров: 803; Нарушение авторских прав

Мы поможем в написании ваших работ!