
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЗАНЯТИЕ №15
Тема: Гетерогенные равновесия и процессы.
Актуальность темы: Формирование костной ткани, неорганическую основу которой составляет гидроксидфосфат кальция, - типичный пример гетерогенного процесса в живом организме. При рН=7,4 (физиологический уровень) в растворе одновременно существуют гидрофосфат- и дигидрофосфат- ионы. Гидрофосфат кальция является менее растворимой солью, он и будет образовываться в первую очередь.
В условиях организма за счет включения буферных систем возможно образование и других солей. Растворимость электролитов в последовательности СаНРО4 ® Са4Н(РО4)3 ® Са5(РО4)3(ОН) постепенно понижается, что и способствует образованию последнего соединения, являющегося термодинамически устойчивой формой фосфата кальция в условиях, характерных для организма.
При образовании костной ткани зуба наряду с гидроксидфосфатом кальция образуется и фторидфосфат кальция Са5(РО4)3F, здесь наблюдается явление изоморфизма. В организме человека костная поверхность имеет площадь около 2000 кв.км.. При кальций- дефицитных состояниях происходит частичное растворение гидроксидфосфата кальция. Поддержание концентрации ионов кальция на постоянном уровне обеспечивают костная ткань и плазма, содержащая фосфат-ионы; такую систему нужно рассматривать как кальциевый буфер. Потребность организма в кальции достаточно велика: для взрослого человека – 8мг на 1 кг массы тела; для беременных и кормящих женщин – 24 мг, для грудных детей 50 мг.
Рассмотрение физико-химических факторов, способствующих (или препятствующих) протеканию гетерогенных процессов в организме возможно только после ознакомления закономерностями образования и растворения труднорастворимых электролитов.
Учебные цели: ознакомиться условиями образования и растворения малорастворимых электролитов в воде, что позволит лучше понимать их приложение к биологическим системам.
В результате освоения темы студент должен уметь:
· Рассчитывать растворимость различных труднорастворимых соединений в их насыщенных растворах;
· Оценивать условия образования и растворения труднорастворимых электролитов;
· Определять влияние одноименного иона, температуры, рН и посторонних сильных электролитов на растворимость осадков;
· Определять совместное и конкурентное осаждение, превращение одних малорастворимых соединений в другие малорастворимые соединения.
Для формирования умений студент должен знать:
· Термодинамические критерии образования осадков в виде правила произведения растворимости;
· Условия образования и растворения труднорастворимых соединений;
· Влияние одноименного иона, рН, температуры и посторонних веществ на растворимость труднорастворимых электролитов;
· Условия совместного и конкурентного осаждения, превращения одних малорастворимых соединений в другие;
· Значение гетерогенных процессов в жизнедеятельности человека.
Вид занятий: лабораторно-практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: штатив с пробирками, мерные пипетки на 10 мл, мерная пробирка, стеклянные палочки, спиртовка со спиртом, держалка для пробирок.
Реактивы: 0,01 М растворы сульфата натрия, хлорида кальция, оксалата натрия; 0,2 М растворы нитрата свинца и хлорида натрия; 1,0 М растворы сульфата натрия и хлорида кальция, 96% этанол, дистиллированная вода, насыщенный раствор хлорида натрия; 0,2 М раствор йодида калия.
Содержание занятия
1. Контроль исходного уровня знаний (тест).
2. Разбор теоретических вопросов и решение типовых задач.
3. Выполнение лабораторной работы;
а) изучение условий образования осадков;
б) влияние одноименного иона на растворимость малорастворимого электролита;
в) изучение влияния температуры и природы растворителя на растворимость осадка;
г) изучение конкурирующих гетерогенных процессов.
4. Выходной контроль по решению ситуационных задач.
5. Проверка протоколов лабораторных работ. Подведение итогов занятия.
6. Задание на дом по теме: «Комплексные соединения и лигандообменные равновесия».
Вопросы и задачи для подготовки к занятию
1. Укажите термодинамические и кинетические условия равновесия в системе твердое вещество – его насыщенный раствор.
2. Сформулируйте правило произведения растворимости. Из какого закона оно вытекает?
3. Приведите математическое выражение правила произведения растворимости для следующих электролитов: AgBr, PbCl2, Ca3(PO4)2 и AxBy.
4. По каким формулам можно рассчитать растворимость следующих электролитов: BaSO4, Ag2CrO4, BiJ3, Ca3(PO4)2 и АхВу?
5. Какие следствия вытекают из правила произведения растворимости? Сформулируйте их.
6. Как влияет присутствие одноименного иона на растворимость осадка? Приведите конкретный пример.
7. Приведите общую схему и конкретный пример, иллюстрирующие 2 конкурирующие гетерогенные процессы: конкуренция за анион и конкуренция за катион.
8. При каких условиях одно малорастворимое соединение переходит в другое малорастворимое соединение?
9. В каких случаях на растворимость труднорастворимого соединения оказывает влияние рН среды? Покажите на примерах и объясните это явление.
10. Влияет ли природа растворителя, температура и посторонние вещества на растворимость труднорастворимого электролита? Чем это объясняется?
11. Приведите примеры гетерогенных процессов, протекающих в живых системах при норме и патологии.
12. Как объяснить, почему радионуклид стронция-90 легко включается в состав костной ткани? Чем это опасно для организма?
13. В растворе имеются ионы Pb2+ и Ва2+. При введении какого аниона в системе будет наблюдаться: а) изолированное гетерогенное равновесие, б) совмещенное гетерогенное равновесие? Какой из двух конкурирующих процессов будет преобладать в случае (б)?
14. К насыщенному водному раствору AgBr добавили: а) раствор NaCl; б) раствор KJ. Опишите возможные изменения в обоих случаях.
15. Для сульфата бария величина произведения растворимости равна 1×10-10. Чему равна молярная растворимость этой соли в его насыщенном растворе? Сколько мг соли содержится в 500 мл этого раствора?
16. Смешали равные объемы 0,001 М раствора хлорида калия и 0,5% раствор нитрата серебра. Выпадет ли при этих условиях осадок хлорида серебра, если ПРAgCl = 1,8×10-10?
Литература:
[1] с. 129; [3] с. 125; [4] с. 60.
Дополнительная:
1. Лекционный материал.
2. Краткий справочник физико-химических величин. Под ред. А.А. Равделя. –Л., Химия, 1983.
Образец билета входного тест-контроля
1. К малорастворимым в воде электролитам относится ряд:
А) кислот Б) солей В) гидроксидов
Г) углеводородов Д) спиртов
Ответ: А,Б,В.
2. Выражение ПР для BiJ3 имеет вид:
А) ПР = S2 Б) ПР = 4S3 В) ПР = 27S4
Г) ПР = 108S5 Д) ПР = а  ×а
×а 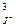
Ответ: В,Д.
3. Растворимость AgCl возрастает в присутствии:
А) NaCl Б) KNO3 В) HCl
Г) AgNO3 Д) C2H5OH
Ответ: Б.
4. Растворимость СаСО3 уменьшается в присутствии:
А) НС1 Б) СаС12 В) Na2CO3
Г) NaOH Д) CO2
Ответ: Б,В.
5. При образовании осадка из раствора происходит:
А) уменьшение энтропии Б) увеличение энтальпии
В) уменьшение энергии Гиббса Г) возрастание энергии Гиббса
Д) увеличение энтропии
Ответ: А,В.
6. Величины ПР труднорастворимых электролитов следующие:
ПРAgCl=1,8×10-10; ПР 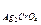 =3,5×10-11; ПР
=3,5×10-11; ПР 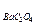 =1,1×10-7; ПР
=1,1×10-7; ПР 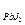 =1,1×10-9;
=1,1×10-9;
ПР 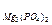 =1×10-13. Наиболее растворимой из них является:
=1×10-13. Наиболее растворимой из них является:
А) AgCl Б) Ag2CrO4 В) BaC2O4
Г) PbJ2 Д) Mg3(PO4)2
Ответ: Д.
7. Труднорастворимые электролиты можно перевести в растворимое состояние:
А) введением одноименных ионов
Б) добавлением кислоты
В) добавлением щелочи
Г) связывая один из ионов в комплекс
Д) связыванием одного из ионов в слабый электролит
Ответ: Б,В,Г,Д.
Информационная часть
К обменным реакциям, протекающим в растворе электролитов, относятся реакции осаждения и растворения.
Обозначим малорастворимое вещество ионного типа МА. При контакте его с водой часть ионов перейдет в жидкую фазу и в некоторый момент времени наступит состояние равновесия (кинетическое условие: скорость растворения равна скорости осаждения; термодинамическое условие: DG=0). Раствор, находящийся в равновесии с твердой фазой, состоящей из МА, называют насыщенным раствором, относительно МА.
Процесс можно представить так:
МАтв « М 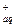 + А
+ А 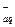
Для константы этого равновесия справедливо:
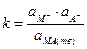
Однако 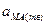 = const, поэтому:
= const, поэтому:
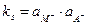 ,
,
где ks=k×a 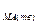 .
.
Константа данного равновесия описывает процессы, связанные с растворением и осаждением. Поэтому эту величину называют произведением растворимости и обозначают ПР. Из II начала вытекает так называемое правило произведения растворимости, которое гласит: «В насыщенном растворе труднорастворимого электролита при постоянной температуре произведение активностей ионов, образующихся при диссоциации, в степенях равных их стехиометрическим коэффициентам, есть величина постоянная».
Величины ПР можно экспериментально определить аналитическими методами. Их табулируют, чаще они приводятся для 25о С. Указание температуры необходимо, т.к. растворимость веществ зависит от температуры, следовательно, и величина ПР зависит от температуры. Например,
· для AgCl:
AgCl «Ag+ + Cl- ks = ПР = а 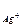 × а
× а 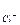 ;
;
· для Са3(РО4)2:
Ca3(PO4)2 « 3Ca2+ + 2PO 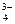 ks = ПР = а
ks = ПР = а 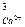 × а
× а 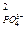 .
.
Для разбавленных растворов (а именно такими являются насыщенные растворы малорастворимых электролитов) можно считать, что ионная сила их настолько мала, что коэффициенты активности ионов равны 1, и, следовательно, активности ионов равны их концентрации. Тогда уравнения можно записать:
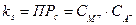 или ПРс = [М+][А-]
или ПРс = [М+][А-]
Для AgCl и Ca3(PO4)2 получим:
ПРс 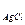 = [Ag+]×[Cl-] и ПРс
= [Ag+]×[Cl-] и ПРс 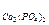 = [Са2+]3×[РО
= [Са2+]3×[РО 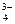 ]2
]2
Однако следует помнить, что в живых системах все гетерогенные равновесия реализуются на значительном электролитном фоне, создаваемым ионами натрия, калия, хлора. Ионная сила крови равна 0,167. Это достаточно высокое значение ионной силы, которым пренебрегать практически нельзя. При этой ионной силе коэффициент активности иона Са2+ составляет 0,42, а фосфат-иона – 0,14.
Пользуясь математическим выражением правила ПР можно рассчитать равновесную концентрацию ионов в насыщенном растворе малорастворимого электролита и растворимость этого вещества.
Из правила ПР вытекают 2 следствия:
1. Условие образования осадка. При образовании труднорастворимого соединения DG<0. Это можно показать путем анализа уравнения изотермы Вант-Гоффа.
Если произведение концентрации (в общем случае произведение активностей) ионов в растворе больше величины ПР, то при данной температуре осадок образуется. То есть ИП > ПР. Это условие образования осадка. Здесь ИП = а 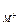 × а
× а 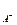 .
.
В общем случае для труднорастворимого электролита типа МmAn:
ИП = а 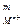 × а
× а 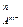 .
.
Если в равновесную систему mMn+ + nAm- = MmAn (тв) ввести один из ионов, например Мn+, то это, в соответствии с принципом Ле-Шателье, приводит к образованию дополнительного количества осадка. Следовательно, присутствие одноименного иона понижает растворимость малорастворимого электролита.
Если к насыщенному раствору BaSO4 добавить K2SO4 или BaCl2, выпадет в осадок еще некоторое количество BaSO4.
Хотя обменные реакции, к которым относятся реакции осаждения, протекают квазимгновенно, однако в ряде случаев этот процесс может идти весьма продолжительно. Здесь играет роль кинетические факторы. Лимитирующей стадией гетерогенного процесса чаще является образование центров кристаллизации.
2. Условие растворения осадка. В ряде случаев при разбавлении, или добавлении кислот, щелочей или комплексообразующих лигандов происходит растворение осадка. Это происходит, если ИП < ПР. Уменьшение ИП происходит за счет связывания одного из ионов, входящих в состав труднорастворимого электролита, в малодиссоциирующее соединение или комплекс. Например:
СаСО3 + 2Н+ = Са2+ + Н2СО3 или AgCl + 3NH3 = [Ag(NH3)2]+ + Cl-
Ион СО 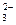 связывается в слабый электролит Н2СО3 при внесении ионов Н+, и резко уменьшается концентрация СО
связывается в слабый электролит Н2СО3 при внесении ионов Н+, и резко уменьшается концентрация СО 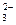 , что приводит к растворению осадка. В случае AgCl ионы Ag+ связываются аммиаком в прочный комплекс, что приводит к уменьшению свободных ионов Ag+ и ИП становится меньше величины ПР, осадок растворяется.
, что приводит к растворению осадка. В случае AgCl ионы Ag+ связываются аммиаком в прочный комплекс, что приводит к уменьшению свободных ионов Ag+ и ИП становится меньше величины ПР, осадок растворяется.
Такое наблюдается в кислой среде для солей слабых кислот и труднорастворимых гидроксидов. Если гидроксид амфотерное соединение, то в щелочной среде оно тоже растворяется, т.к. образуется гидроксокомплекс с участием иона металла. Поэтому в кислой среде не выпадают в осадок соли слабых кислот и гидроксиды металлов.
В реальных системах редко встречаются изолированные гетерогенные равновесия: присутствие в биожидкостях большого числа ионов приводит к тому, что одновременно могут образовываться несколько малорастворимых веществ. Например, в системе присутствуют анионы А- и В-, которые с катионом М+ образуют малорастворимые соединения. Если электролиты однотипны и имеют примерно одинаковые величины ПР, то при одинаковых концентрациях А- и В- преобладание какого-либо одного процесса (образование МА или МВ) не наблюдается. Если же соединения МА и МВ различаются величинами ПР, то преимущественно будет протекать образование менее растворимого соединения. Если ПРМА > ПРМВ то при равных концентрациях А- и В- будет образовываться МВ. Иначе, конкуренцию за общий катион выигрывает тот анион, который с этим катионом образует менее растворимое, а следовательно, более прочное соединение. Аналогичны рассуждения и в отношении конкуренции за общий анион.
Если концентрацию иона, являющегося объектом конкуренции, поддерживать постоянной, будет наблюдаться явление, называемое дробным осаждением: сначала образуется менее растворимое, а затем – более растворимое соединение.
Конкуренция за общий ион может быть представлена и в иной форме. Допустим, имеется осадок МА. При добавлении к этому раствору с осадком аниона В-, способного также к образованию осадка с М+, может произойти изменение состава твердой фазы:
МАТВ + В 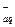 ® МВТВ + А
® МВТВ + А 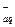
Самопроизвольно этот процесс будет происходить при условии ПРМВ < ПРМА. Если наоборот ПРМВ > ПРМА, процесс самопроизвольно в закрытой системе не будет протекать. Для его осуществления надо постоянно поддерживать высокую концентрацию В- против А-. Практически это можно осуществлять, сливая надосадочную жидкость, содержащую А-, и добавляя к осадку раствор, содержащий В-.
Рассмотренные закономерности имеют большое значение для уяснения гетерогенных процессов, протекающих в организме в норме и при патологии.
Патологический процесс замещения ионов кальция в гидроксидфосфате кальция на ионы стронция Sr5(PO4)3OH основан на переходе более растворимой соли в менее растворимую. Особенно опасно замещение ионов кальция на ионы радионуклида стронция-90 (бета-излучатель, период полураспада 27,7 лет). Содержание радионуклида стронций-90 в окружающей среде тем больше, чем больше мощность взорванных атомных устройств. Радиоактивная пыль, питьевая вода, растительность и молочная пища являются источником Sr-90. Радионуклид, включаясь в костную ткань, становится внутренним источником облучения организма, что приводит к развитию онкологических заболеваний (лейкемия, саркома). Кроме того, b-излучение Sr-90 влияет на наследственность.
В природе существует феномен «дискриминация стронция»: соотношение Са / Sr в растениях в 2 раза больше, чем в почве, на которой они произрастают; оно еще в большей степени увеличивается (в 5-10 раз) в организме животных, потребляющих в пищу эти растения. Тем не менее, часть ионов стронция попадает в организм человека и включается в костную ткань. Если подходить к этому вопросу с термодинамической точки зрения, то приходится констатировать, что конкуренцию за фосфат-тон выигрывает ион Sr2+, а не ион Са2+. Как это было отмечено ранее, это особенно опасно в случае радионуклида Sr-90.
Структура кристалла гидроксидфосфата кальция обеспечивает легкость обмена ионами с окружающими тканевыми жидкостями. При кальций-дефицитных состояниях происходит частичное растворение гидроксидфосфата кальция, за счет чего концентрация Са2+ в тканевых жидкостях выравнивается. Ионы кальция играют очень важную роль в организме: они участвуют в процессе мышечного сокращения, способствуют свертыванию крови, активируют действие многих ферментов, регулируют проницаемость клеточных мембран. Например, концентрация ионов Са2+ в организме беременной женщины снижается, т.к. часть ионов кальция материнского организма расходуется на построение скелета плода. Для приведения уровня Са2+ к норме он высвобождается из депо костной ткани, поэтому в период беременности часто разрушаются зубы.
При введении в насыщенный раствор гидроксидфосфата кальция какой-либо соли кальция, т.е. при создании избытка ионов Са2+, часть соли находящейся в растворе перейдет в состав твердой фазы. Поверхность зубов постоянно контактирует с большим количеством жидкости, это является физико-химическим фактором, способствующим их разрушению (растворению). Повышенная концентрация иона Са2+ в слюне (одноименный ион), наоборот снижает растворимость этого соединения и является стабилизирующим физико-химическим фактором.
Помимо нормально протекающих гетерогенных процессов в организме идут и патологические процессы. Благодаря такому явлению, как изоморфизм, вместе с кальциевыми солями могут осаждаться соли и других металлов, близких по своим свойствам к кальцию: кадмия, бериллия, бария и уже упоминавшегося стронция. Соединения бериллия являются очень токсичными соединениями. Присутствие даже небольшого количества бериллия в окружающей среде приводит к тяжелому заболеванию – бериллозу (бериллиевый рахит). Ионы бериллия нарушают процесс включения кальция в костную ткань, вызывая ее размягчение. Предельно допустимая концентрация (ПДК) соединений бериллия в питьевой воде в 500 раз меньше (0,0002 мг/л), чем соединений такого же токсичного элемента свинца (0,1 мг/л).
Кроме фосфатов, ионы кальция образуют и другие малорастворимые соединения в организме. На утонченных стенках артерий происходит образование карбоната кальция. Этот процесс кальциоз (артериосклероз) наблюдается, как правило, в старости.
При нарушении обмена веществ могут локально повышаться концентрации некоторых ионов. Повышение концентрации оксалат-ионов в организме может привести к отложению оксалата кальция. Они образуются в почках и мочевом пузыре при почечнокаменной болезни (оксалурия).
Малорастворимые соли мочевой кислоты откладываются в суставах, фасциях, хрящах, вызывая такое заболевание, как подагра. Фактические механизмы этих процессов гораздо более сложные, т.е. в регулировании гетерогенных процессов принимают участие много веществ, в том числе витамины и ферменты.
При повышенной активности ксантиноксидазы – фермента, содержащего молибден, способствующего превращению пуриновых оснований в мочевую кислоту, локально возрастает концентрация уратов – солей мочевой кислоты. Малорастворимые соли мочевой кислоты, откладываясь в суставах, вызывают заболевание – подагру.
Вместе с тем гетерогенные равновесия в организме применяются и для терапевтических целей при растворении различных камней. Для растворения оксалатов и уратов применяют соли лития и винно-каменной кислоты. Ураты лития являются более растворимыми, чем ураты других металлов. Для этого обеспечивают постоянную высокую концентрацию ионов лития.
Разбор типовых задач
1. Вычислите массу карбоната кальция, находящегося в его насыщенном растворе объемом 3 л.
Решение: Растворение СаСО3 происходит вследствие процесса:
СаСО3 (тв) « Са 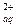 +СО
+СО 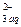
Обозначим концентрацию ионов Са2+ через х. Тогда
[Ca2+] = [CO 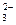 ] = [CaCO3] = х.
] = [CaCO3] = х.
Для простоты примем коэффициент активности равный 1, тогда согласно правилу произведения растворимости:
ПР 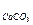 = [Ca2+][CO
= [Ca2+][CO 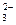 ] = х2
] = х2
Отсюда:
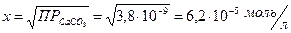
Масса СаСО3 будет равна (М  =100 г/моль):
=100 г/моль):
M = C × V × M = 6,2 × 10-5 × 3 × 100 = 1,86 × 10-2 г.
2. В насыщенный раствор хлорида свинца ввели хлорид калия с концентрацией 0,1 моль/л. Вычислите растворимость PbCl2 в моль/л и массу ионов Pb2+ в 1 л этого раствора.
Решение: Растворение PbCl2 можно представить:
PbСl2 (тв) « Pb 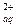 + 2Сl
+ 2Сl 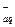
В присутствии одноименных ионов Cl- (после введения КС1) растворимость уменьшается, т.к. равновесие смещается влево. Обозначим концентрацию ионов Pb2+ через S, тогда [C1-] = 2S + 0,1.
Согласно правилу произведения растворимости ПР 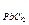 = [Pb2+][Cl-]2 (при условии принятия коэффициентов активностей равными 1).
= [Pb2+][Cl-]2 (при условии принятия коэффициентов активностей равными 1).
Подставляя концентрации ионов Pb2+ и С1-, имеем:
ПР 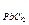 = S×(2S+0,1).
= S×(2S+0,1).
Для упрощения учтем, что S<<0,1, тогда:
ПР 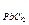 = 0,1 × S.
= 0,1 × S.
Откуда:
S = 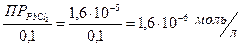
Величину ПР 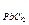 берем из справочника.
берем из справочника.
Так как [PbС12] = [Pb2+], то это и будет растворимость PbCl2 в присутствии 0,1 М КCl. Допущение, что S<<0,1, оправдалось, т.к. 1,6×10-6<<0,1.
Массу ионов Pb2+ найдем по формуле:
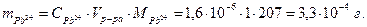
3. Смешали равные объемы двух растворов: ацетата свинца с концентрацией 0,001 моль/л и 1%-ный раствор оксалата натрия с плотностью 1,01 г/мл. Образуется ли при этом осадок?
Решение: При смешении растворов ацетата свинца и оксалата натрия протекает реакция:
Pb(CH3COO)2 + Na2C2O4 = PbC2O4 + 2CH3COONa
В ионном виде:
Pb2+ + C2O  = PbC2O4
= PbC2O4
Осадок оксалата свинца может выпасть, если выполняется условие:
[Pb2+][C2O  ] > ПР
] > ПР 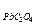
Из таблицы возьмем: ПР 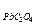 =4,8×10-10.
=4,8×10-10.
Найдем концентрации [Pb2+] и [C2O  ] с учетом разбавления:
] с учетом разбавления:
[Pb2+] = 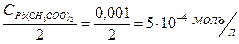
Молярная концентрация Na2C2O4 равна:
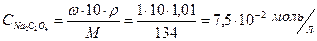
[C2O  ]=
]= 
ИП = [Pb2+][C2O  ] = 5×10-4 × 3,75×10-2 = 1,9×10-5
] = 5×10-4 × 3,75×10-2 = 1,9×10-5
Как видно 1,9×10-5 > 4,8×10-10, следовательно, осадок выпадет.
4. Какой концентрации йодид-ионов следует достичь, чтобы из насыщенного водного раствора хлорида серебра выпал осадок йодида серебра?
Решение: Из таблицы найдем значения произведения растворимости для AgC1 и AgJ: ПРAgCl = 1,8×10-10; ПРAgJ = 8,3×10-17.
Как видно, AgJ является менее растворимой солью, чем AgCl. При определенных концентрациях йодид-ионов хлорид серебра может перейти в йодид серебра.
Для AgCl: AgClтв « Ag 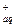 + Cl
+ Cl 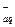
ПРAgCl = [Ag+][Cl-] = S2,
где S – молярная растворимость AgCl.
[Ag+] = [AgCl] = S = 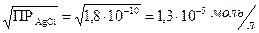
Ag 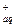 + J
+ J 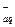 « AgJтв
« AgJтв
ПРAgJ = [Ag+][J-],
Отсюда:
[J-] = 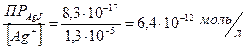
Таким образом, уже при концентрациях выше 6,4×10-12 моль/л йодид-ионов осадок AgCl (белого цвета) превращается в осадок AgJ (желтого цвета).
Лабораторная работа
Задание 1. Изучение условий образования осадков.
В две пробирки внесите по 3 мл 0,01 М раствора хлорида кальция. В одну из них добавьте 3 мл 0,01 М раствора оксалата натрия, а в другую 3 мл 0,01 М раствора сульфата натрия.
Наблюдения внесите в таблицу:
| Катион с моль/л | Анион с моль/л | Концентрация после смешения | Ионное произведение (ИП) | ПР | Наблюдения |
| Са2+ 0,01 | С2О  0,01
0,01
| ||||
| Са2+ 0,01 | SO  0,01
0,01
|
Задание 2. Влияние одноименного иона на растворимость малорастворимого электролита.
В пробирку налейте 5 капель 0,2 моль/л раствора нитрата свинца. Добавьте несколько капель 0,2 моль/л раствора хлорида натрия до образования осадка. К содержимому пробирки прилейте 3 мл дистиллированной воды и тщательно перемешайте раствор до полного растворения осадка. Прозрачный раствор разделите пополам и в одну из них добавьте 0,5 мл насыщенного раствора NaCl. Наблюдайте повторное выпадение осадка. Объясните процессы растворения и повторного выпадения осадков исходя из правила произведения растворимости.
Задание 3. Изучение влияния температуры и природы растворителя на растворимость осадка.
К 2 мл 0,2 М раствора нитрата свинца добавьте несколько капель 0,2 М раствора хлорида натрия. Наблюдайте образование осадка. Содержимое пробирки нагрейте на пламени спиртовки, взяв пробирку держалкой. Наблюдайте растворение осадка. Затем пробирку внесите под струю холодной воды и наблюдайте повторное выпадение осадка. Объясните наблюдаемые явления.
В другую пробирку налейте 2 мл 1 М раствора хлорида кальция, затем добавьте 1 мл 1 М раствора сульфата натрия. Почему не выпадает осадок? Затем к полученному раствору добавьте 1-2 мл этанола до выпадения осадка. Почему в этом случае выпал осадок? Объясните эти явления.
Задание 4. Изучение конкурирующих гетерогенных процессов.
В 2 пробирки внесите по 2 мл 0,02 М раствора нитрата свинца и добавьте в каждую из них по 2 мл 0,2 М раствора NаCl до выпадения осадка. Затем в одну из пробирок добавьте 1 мл 0,2 М раствора KJ. Встряхните пробирку и наблюдайте, как меняется цвет осадка. Чем это объясняется?
Во всех опытах напишите молекулярные и ионные уравнения протекающих реакций.
Ситуационные задачи для контроля усвоения темы
1. В пробирке находится смесь 0,1 М растворов: хлорида натрия, бромида калия и йодида калия. Постепенно по каплям к этой смеси добавляют 0,1% раствор нитрата серебра. В какой последовательности будут выпадать в осадок соли? Ответ объяснить пользуясь величинами ПР соответствующих солей.
2. Возможен ли перевод PbSO4 в PbS? В чем визуально это выражается? Возможен ли перевод PbS в PbSO4?
3. В растворе имеются фосфат- и хлорид- ионы. При введении какого катиона будут наблюдаться: а) выпадение в осадок только одного иона; б) выпадение в осадок обоих ионов?
4. В растворе имеются ионы магния и кальция. При введении какого аниона в системе будет наблюдаться: а) изолированное гетерогенное равновесие; б) совмещенное гетерогенное равновесие? Какой из двух конкурирующих процессов будет преобладать в случае (б)?
5. К насыщенному водном раствору SrSO4 добавили: а) раствор Ca(NO3)2; б) раствор Ba(NO3)2. Опишите возможные изменения в обоих случаях и объясните их.
6. Сколько грамм ионов Ag+ находится в 10 л насыщенного раствора AgBr (ПР=5,3×10-13).
7. Раствор карбоната калия с концентрацией 0,001 М находится в контакте с осадком карбоната кальция. Чему равна концентрация ионов кальция в жидкости над осадком? Вычислите массу кальция, находящегося в виде ионов в 0,5 л такой жидкости (ПР 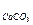 = 3,8×10-9).
= 3,8×10-9).
8. Раствор ацетата кальция приготовили смешением соли массой 1 г с водой 350 мл. Этот раствор смешали с раствором сульфата натрия с концентрацией 0,025 моль/л, причем объемы смешиваемых растворов были равны между собой. Образуется ли осадок в этих условиях? (ПР 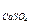 = 2,5×10-5)
= 2,5×10-5)
9. Смешали 100 мл 2%-ного раствора K2SO4 (r=1,02) и 150 мл 5%-ного раствора Pb(NO3)2 (r=1,04). Выпадет ли осадок? (ПР 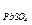 = 1,6×10-8)
= 1,6×10-8)
10. При какой концентрации СО 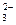 -ионов образуется осадок из 0,5 моль/л раствора Ca(NO3)2? (ПР
-ионов образуется осадок из 0,5 моль/л раствора Ca(NO3)2? (ПР 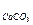 = 3,8×10-9).
= 3,8×10-9).
11. Вычислите массу Pb(NO3)2, которую надо добавить к водному раствору Na2CO3 с концентрацией 0,01 моль/л объемом 200 мл, чтобы получить осадок (ПР 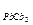 = 7,5×10-14).
= 7,5×10-14).
12. Какой концентрации ионов Ва2+ следует достичь, чтобы из насыщенного водного раствора СаSO4 выпал осадок ВаSO2? (ПР 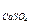 = 2,5×10-5, ПР
= 2,5×10-5, ПР 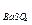 = 1,1×10-10)
= 1,1×10-10)
Домашнее задание
Тема: «Комплексные соединения и лигандообменные равновесия».
Литература: [1] с. 191; [3] с. 174; [4] с. 72.
Дополнительная:
1. Лекционный материал.
2. Ахметов Н.С. Общая и неорганическая химия. –М., Высшая школа, 2002.
3. Неорганическая биохимия. Под ред. Г. Эйхгорна. М., Мир, 1978. т. 1 и 2.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАНЯТИЕ №14 | | | ЗАНЯТИЕ №16 |
Дата добавления: 2014-09-10; просмотров: 1479; Нарушение авторских прав

Мы поможем в написании ваших работ!