
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЗАНЯТИЕ №16
Тема: Комплексные соединения и лигандообменные равновесия.
Актуальность темы: Практически все ионы d-элементов в условиях организма находятся в связанном состоянии, т.к. образуют комплексные соединения с различными биолигандами, в состав которых входят донорные атомы кислорода, азота, серы. Биокомплексные соединения значительно различаются по своей устойчивости. Одни из них настолько прочны, что постоянно находятся в организме и выполняют определенную функцию. Роль металла в таких комплексах высокоспецифична; замена его даже на близкий по физико-химическим параметрам металл приводит к значительной или полной утрате физиологической активности. Примерами таких соединений является гемоглобин (только кобальтовый аналог этого соединения обладает незначительной способностью связывать и переносить кислород); витамин В-12, хлорофилл. С другой стороны, в организме есть весьма непрочные комплексные соединения, которые часто образуются только на то время, которое нужно для выполнения определенных функций (например, образование между ионом металла - активатором и ферментом комплексного соединения на период осуществления катализа). Специфичность металла таких комплексов часто не ярко выражена, он может быть заменен на другой без потери физиологической активности.
К биокомплексам с невысокими значениями констант устойчивости можно отнести и такие, которые стабилизируют сложные структуры. Например, образование металлополинуклеотидных комплексов стабилизирует двойную спираль ДНК.
В живых организмах найдено много ферментов, в состав которых входят ионы металлов. Для организма характерно не только протолитический и ионный гомеостаз, но также поддержание на постоянном уровне и концентрации веществ лигандообменных равновесий. Нарушение металлолигандного гомеостаза приводит к различным патологиям. В таких случаях организм включает защитные механизмы и со временем возвращает основные показатели к норме. Однако в ряде случаев возникает необходимость в проведении фармакотерапии.
Учебные цели: сформировать системные знания по теории равновесий комплексообразования для обоснования протекающих в условиях живых организмов образования и разрушения биокомплексных соединений и поддержания металлолигандного гомеостаза.
В результате освоения темы студент должен уметь:
· Различать простые и комплексные соединения;
· Написать по названию и называть по формулам комплексные соединения;
· Писать уравнения реакции образования комплексных соединений по реакциям внедрения и присоединения;
· Писать уравнения реакции диссоциации комплексных соединений и выражать константы устойчивости или нестойкости комплексного иона;
· Определять валентность (или степень окисления) и координационное число комплексообразователя и заряд комплексного иона, дентантность лигандов;
· Предсказывать комплексообразующую способность металлов и неметаллов на основе электронного строения их атомов;
· Оценивать прочность комплексных соединений на основании их констант устойчивости или нестойкости.
Для формирования умений студент должен знать:
· Сущность координационной теории А. Вернера;
· Понятия: комплексообразователь (центральный атом), лиганды (адденды), координационное число, дентантность лиганда;
· Классификацию комплексных соединений по заряду комплексного иона и по природе лиганда;
· Современную номенклатуру комплексных соединений;
· Типы гибридизации комплексообразователя и геометрическую форму комплексных ионов;
· Изомерию комплексных соединений;
· Биологическую роль важнейших биокомплексов и применение комплексообразования в медицине.
Вид занятий: лабораторно-практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: штатив с пробирками, мерные пробирки, пипетки, фильтровальная бумаги, стеклянная палочка, таблица с константами устойчивости и нестойкости комплексных соединений, калькуляторы.
Реактивы: 0,1 М растворы CuSO4, Bi(NO3)3, KJ, KOH, NaCl, FeCl3, H2C2O4, KCNS, HNO3, H2SO4; 10% раствор NH3; 0,1% растворы AgNO3 и KMnO4; сухие соли K4[Fe(CN)6] и FeSO4; металлический Zn.
Содержание занятия
1. Контроль исходного уровня знаний (тест).
2. Разбор теоретических вопросов и решение ситуационных задач.
3. Выполнение лабораторной работы:
а) получение комплексных соединений;
б) диссоциация и разрушение комплексных ионов;
в) изучение окислительно-восстановительных свойств комплексных ионов.
4. Выходной контроль знаний. Проверка протоколов лабораторных работ.
5. Подведение итогов занятия. Задание на дом по теме: «Электрохимические методы исследования. Потенциометрия».
Вопросы и задачи для подготовки к занятию
1. В чем различие простых и комплексных соединений?
2. В чем сущность координационной теории А. Вернера чем сущность координационной теореии А. ненийных ионовкомплексообразования в медицинеивости или нестойкости комплексного иона;?
3. Классификация комплексных соединений: а) по заряду комплексного иона, б) по природе лиганда.
4. Внутрикомплексное соединения (хелаты).
5. Константы устойчивости и нестойкости комплексных соединений. Связь между ними.
6. Лигандообменные процессы в жизнедеятельности и их значение.
7. Понятие о металло-лигандном гомеостазе.
8. Понятие о хелатотерапии и ее применение.
9. Приведите примеры биокомплексных соединений, содержащих железо, кобальт, цинк.
10. Напишите формулы следующих комплексных соединений: гексанитрокобальтат (III) натрия; хлорид гексаамминникеля (II); дибромодихлороаурат (III) кальция; сульфат бромопентааминкобальта (III); хлорид дихлородиамминплатины (IV).
11. Возможно ли в стандартном состоянии замещение лигандов: а) в тетрацианоцинканат-ионе на аммиак; б) в динитроаргентат-ионе на цианид-ион; в гексацианоферрат (III)-ионе на фторид-ион? Ответ подтвердите, пользуясь справочными данными.
12. Вычислите концентрации иона цинка в растворе тетрацианоцинката натрия с концентрацией 0,01 моль/л, если цианид-ионы имеют концентрацию 0,3 моль/л, а константа нестойкости комплекса равна 2,4×10-20.
13. Напишите уравнения диссоциации комплексных соединений: K3[Co(NO2)6]; [Ni(NH3)6]SO4; [Co(NH3)4Cl2]SO4; Mg[Pt(CN)4]. Приведите выражения полных констант нестойкости комплексных ионов.
14. Константа нестойкости комплексного иона [Ag(NH3)2]+ равна 6×10-8. Рассчитайте концентрацию ионов комплексообразователя в 0,001 М растворе.
15. Пригототвлен раствор объемом 1 л смешением воды с 0,2 моль нитрата серебра и 0,5 моль аммиака. Вычислите концентрацию ионов серебра в этом растворе, если kнест комплекса равен 6×10-8.
Литература:
[1] с. 191; [3] с. 174; [4] с. 72.
Дополнительная:
1. Ахметов Н.С. Общая и неорганическая химия. М., Высшая школа, 2002.
2. Неорганическая биохимия. Под ред. Г. Эйхгорна. М., Мир, 1978. т.1 и 2.
Образец билета входного тест-контроля
1. Названию трифторогидроксобериллат магния соответствует формула комплексного соединения:
А) Mg(OH)2×BeF2 Б) Mg[BeF3(OH)] В) Be[MgF3(OH)]
Г) Mg[BeF2(OH)2] Д) Be[Mg(OH)2F2]
Ответ: Б.
2. Заряд комплексообразователя в комплексном соединении Ba[Pt(NO3)2Cl2] равен:
А) +2 Б) -1 В) +4 Г) 0 Д) -4
Ответ: А.
3. Тип гибридизации центрального иона в комплексе Na[AlF4]:
А) sp Б) sp2 В) sp3 Г) d1sp3 Д) d2sp3
Ответ: В.
4. Данные лиганды являются бидентантными:
А) Cl- Б) S2O 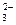 В) NH2CH2COOH Г) CN- Д) NH3
В) NH2CH2COOH Г) CN- Д) NH3
Ответ: Б,В.
5. В комплексных соединениях [Co(NH3)6][Cr(CN)6] и [Co(CN)6][Cr(NH3)6] имеется вид изомерии:
А) гидратная Б) ионизационная В) координационная
Г) геометрическая Д) межрядовая
Ответ: В.
6. Данные комплексные соединения образуются за счет реакций внедрения:
А) K[Ag(CN)2] Б) [Cu(NH3)4]SO4 В) Na3[Co(NO2)6]
Г) K2[HgJ4] Д) [Ni(NH3)6]SO4
Ответ: Б,Д.
7. В левой колонке приведены комплексные ионы, в правой их константы нестойкости. Укажите самый прочный и наименее прочный комплексы:
А) [HgCl4]2- 1) 8,5×10-16
Б) [HgBr4]2- 2) 1,0×10-21
В) [Cd(CN)4]2- 3) 7,8×10-18
Г) [Cu(NH3)4]2+ 4) 1,0×10-12
Д) [PtCl4]2- 5) 1,0×10-16
Ответ: Б,Г.
8. Для комплексного соединения Na2[Os(NO2)2Cl4] выражение константы нестойкости имеет вид:
А) 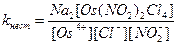 Б)
Б) 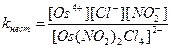
В) 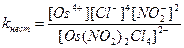 Г)
Г) 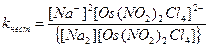
Д) 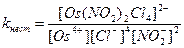
Ответ: В.
Информационная часть
Комплексные соединения представляют собой сложные молекулярные частицы, образованные центральным атомом (ионом) и лигандами - заряженными или незаряженными частицами. Лиганды являются донорами неподеленных электронных пар, а центральный атом (ион), называемый также комплексообразователем, -акцептором электронов. Количество координированных вокруг комплексообразователя лигандов определяется координационным числом. Координационное число центрального атома всегда выше его степени окисления, т.к. часть ковалентных связей образуется по обменному, а часть – по донорно-акцепторному механизму.
Лиганды могут быть как нейтральными частицами (молекулы воды, аммиака, органических аминов и др.), так и анионами (гидроксид-, цианид-, галид- и др.). Если в составе лиганда находится один донорный атом, т.е. атом, способный предоставить для образования ковалентной связи по донорно-акцепторному механизму неподеленную пару электронов, то такой лиганд называется монодентантным. Выше перечисленные лиганды являются монодентантыми. Бидентантные лиганды имеют в своем составе два донорных атома, например, этилендиамин (два атома азота). Полидентантными лигандами являются молекулы, имеющие более двух донорных атомов, доступных для координации.
Для составления названия комплексного соединения указывают в следующем порядке: число лигандов (моно-, ди-, три-, тетра-, пента-, гекса- и т.д.), название лиганда (если их несколько, то сначала анионные, потом нейтральные, перечисление производят в алфавитном порядке) и в последнюю очередь – центральный атом.
Комплексные катионы и нейтральные комплексы не имеют отличительных суффиксов, комплексные анионы имеют суффикс – ат, который добавляют к латинскому названию атома комплексообразователя. После названия комплексообразователя указывают в скобках степень его окисления.
Названия анионных лигандов оканчиваются на – о: сульфато-, тиосульфато-, фосфато-, нитрато-. Для некоторых лигандов используются видоизмененные названия: фторо- (F-), хлоро- (С1-), бромо- (Br-), йодо- (J-), меркапто- (HS-), нитро- (NO 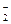 ). Для нейтральных лигандов используются немодифицированные названия (например, мочевина, пиридин, этилендиамин и др.). Исключения составляют: вода – «акво» и аммиак – «аммин». Группы NO и СО, если они связаны непосредственно с ионами металла, называются «нитрозил» и «карбонил».
). Для нейтральных лигандов используются немодифицированные названия (например, мочевина, пиридин, этилендиамин и др.). Исключения составляют: вода – «акво» и аммиак – «аммин». Группы NO и СО, если они связаны непосредственно с ионами металла, называются «нитрозил» и «карбонил».
Для указания комплексообразователя в нейтральных комплексах и комплексных катионах используют русские названия соответствующих элементов. Например:
[Pt(NH3)3Cl]Cl – хлорид хлоротриамминплатины(II);
(NH4)2[Pt(OH)2Cl4] – дигидроксотетрахлороплатинат(IV) аммония;
[Pt(NH3)2Cl2] – дихлородиамминплатина.
Комплексные соединения делятся на электролиты и неэлектролиты (например, тетракарбонилникель [Ni(CO)4]). Среди комплексных электролитов различают кислоты (гексофторокремниевая кислота H2[SiF6]), основания (гидроксид диамминсеребра [Ag(NH3)2]OH) и соли.
Особый интерес представляют хелатные соединения. В их состав входят полидентантные лиганды, образующие не меньше двух связей с центральным атомом. Отличительной особенностью хелатных соединений является наличие циклических группировок атомов, включающих атом металла. Хелатами являются многие металлопротеиды, выполняющие функции в организме (ферменты, витамины, гемоглобин и др.). В хелатных соединениях ион металла оказывается зажатым клешней, отчего и произошло их название (хела – клешня).
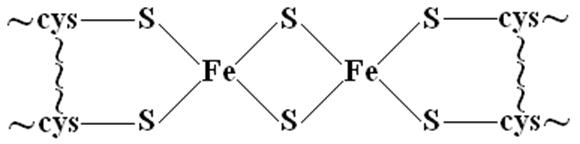
К особым классам комплексных соединений относятся полиядерные комплексы. Для них характерно наличие нескольких координационных центров, т.е. центральных атомов с координированными лигандами. Связи между отдельными координационными центрами осуществляются за счет мостиковых лигандов.
Пример (схематично) – один из железопротеинов, широко распространненых в живых системах. Здесь: cys – остатки аминокислоты цистеина, ~ - белковый фрагмент.
Макроциклические комплексные соединения образованы полидентантными лигандами, внутри которых размещается центральный атом. Лиганды называются в этом случае «хозяином», а центральный атом - «гостем». «Гость» размещается во внутренней полости «хозяина», в какой-то степени изолирован от окружающей среды. Принцип макроциклического связывания широко используется в природе; особый интерес представляют мембранно-активные комплексы (ионофоры). К числу таких ионофоров относится хорошо известный антибиотик валиномицин.
Весьма интересны для биологии и медицины металлоцены, так называемые «сэндвичевы» соединения. Для «сэндвичевых» соединений характерно взаимодействие вакантных орбиталей центрального атома с p - электронами, например ароматических или ненасыщенных структур.
В медицине используется препарат ферроцерон, являющийся производным ферроцена – бис(циклопентадиенил) железа: Fe(C5H5)2.
Схематично процесс комплексообразования можно представить:
Меz+ + nLx- « [MeLn]z-nx, где
Меz+ - ион атома-комплексообразователя,
Lx- - лиганд.
С термодинамических позиций устойчивость образовавшегося комплексного иона характеризуется константой устойчивости:
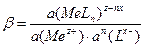
По значению константы устойчивости b с помощью уравнения изотермы реакции можно рассчитать стандартную энергию Гиббса образования комплекса:
DGо = -R×T×lnb
Эта величина является энергетической характеристикой реакции образования комплексных соединений.
Чаще устойчивость комплексных соединений характеризуют константой нестойкости:
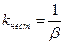
Константы нестойкости позволяют прогнозировать направление лигандообменных процессов. В воде в отсутствие других лигандов ион металла существует в виде аквокомплексов, т.е. комплексов, в котором вокруг центрального иона координированы молекулы воды:
[Cu(H2O)4]2+ - тетрааквамедь (II)
[Fe(H2O)6]3+ - гексаакважелезо (III)
Образование в водной среде комплекса между ионом металла и каким-либо лигандом можно рассматривать как реакцию замещения молекул воды во внутренней координационной сфере на этот лиганд:
[Ме(Н2О)n]+ + nL « [MeLn]+ + nH2O
Прочность образующихся комплексных соединений зависит от:
· природы реагирующих веществ;
· природы растворителя (в малополярных растворителях прочность комплексов выше);
· температуры;
· рН среды.
Ионы железа (III) образуют с салициловой кислотой комплексы разной прочности, разного состава и разного цвета в зависимости от рН.
| рН=1,0 Fe(C8H4O4)+ Kнест=4×10-17, lmax=530 нм | рН=2,5
Fe(C8H4O4) 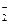 Kнест=3,5×10-12, lmax=480 нм
Kнест=3,5×10-12, lmax=480 нм
| рН=7,4
Fe(C8H4O4) 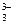 Kнест=2×10-6, lmax=440 нм
Kнест=2×10-6, lmax=440 нм
|
Комплексообразующая способность центрального атома определяется его электронным строением.
Например, ион Сu2+ имеет близкие по энергии и свободные 4s1 и 4p3 орбитали. При взаимодействии с лигандами, например NH3, эти орбитали подвергаются sp3 гибридизации. За счет неподеленной электронной пары NH3 и 4-х свободных орбиталей меди (II) возникает 4 равноценные двухэлектронные s-связи N-Cu2+ по донорно-акцепторному механизму.
В случае иона Fe2+ за счет спаривания холостых электронов возникает 6 свободных орбиталей: d2sp3, близкие по энергии. После d2sp3 гибридизации они выравниваются и могут образовать 6 ковалентных s-связей с атомами донорами, например атомом N в CN—ионе. Здесь механизм также донорно-акцепторный.
Геометрия комплексных ионов определяется типом гибридизации центрального иона. Если sp3- гибридизация, то или тетраэдр в NH  , или квадрат (комплексы Cu2+ и Zn2+), если d2sp3- гибридизация – то, форма комплексного иона – октаэдрическая (комплексы Fe2+, Fe3+, Co2+). Координационные числа комплексообразователей также определяются типом гибридизации их свободных орбиталей.
, или квадрат (комплексы Cu2+ и Zn2+), если d2sp3- гибридизация – то, форма комплексного иона – октаэдрическая (комплексы Fe2+, Fe3+, Co2+). Координационные числа комплексообразователей также определяются типом гибридизации их свободных орбиталей.
В отличие от реакций ионного обмена образование комплексных соединений не является квазимгновенным процессом.
Для кинетической характеристики комплексных соединений используются понятия: лабильный – быстро вступающий в реакции и инертный – медленно вступающий в реакции. Эти понятия применяются в отношении конкретной реакции, т.е. комплексного соединения и реагента.
В комплексных соединениях, в отличие от простых молекул, существуют явление изомерии. Различают 4 вида изомерии комплексных соединений:
· координационная, когда различные лиганды могут в одном соединении координироваться то у одного, то у другого комплексообразователя. Примером являются соединения: [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6].
· ионизационная, когда различные лиганды находятся то во внутренней сфере, то во внешней сфере. Примерами являются соединения: [Co(NH3)5Cl]SO4 и [Co(NH3)5SO4]Cl.
· гидратная, когда молекулы воды могут находиться во внутренней сфере как лиганды или во внешней сфере как кристаллизационная вода. Примерами являются соединения: [Co(H2O)6]Cl3 и [Co(H2O)6Cl]Cl2×H2O.
· геометрическая, когда относительно плоскости комплексообразователя лиганды могут находиться по одну сторону плоскости (цис-изомер) или по разные стороны плоскости (транс-изомер). Так комплексное соединение [Pt(NH3)2Cl2] имеет цис- и транс- изомеры. Цис- изомер дихлородиаммин платины обладает цитотоксическим действием к раковым клеткам, а транс- изомер не обладает этим свойством.
При наличии в растворе нескольких лигандов, способных к образованию комплексного соединения с ионом металла, наблюдается совмещенное лигандообменное равновесие. Процессы образования комплексного соединения иона металла с каждым из этих лигандов будут конкурирующими между собой. Преобладающим будет тот, который приводит к образованию наиболее прочного (т.е. с наименьшей константой нестойкости) комплексного соединения.
Могут быть и такие совмещенные лигандообменные равновесия, в которых объектом конкуренции является лиганд, а конкурирующими между собой частицами – ионы металлов.
Например, если в растворе присутствуют ион цинка, аммиак и цианид-ион. Ион цинка способен образовывать:
а) аквокомплксы (лиганд – вода);
б) амминокомплексы (лиганд – аммиак);
в) цианидный комплекс.
Более прочный является цианидный комплекс, процесс его образования и будет преобладать в данной системе.
В медицине применяющаяся этилендиаминтетрауксусная кислота или ее динатриевая соль – сокращенно ЭДТА является полидентантным лигандом. Это 4-х основная кислота (Н4Y) или ее динатриевая соль (Na2H2Y) образуют прочные комплексы почти со всеми металлами (кроме щелочных) постоянного состава 1:1. Если в растворе имеются ионы металлов: магния, цинка, меди (II) и железа (III), то при введении в такой раствор ЭДТА в небольшом количестве будет происходить связывание того иона, который образует наиболее прочный комплекс, т.е. железа (III). По мере добавления новых порций ЭДТА будет происходить связывание и других ионов в такой последовательности: меди (II), цинка, магния (сравните константы нестойкости комплексонатов этих металлов). Заключение о сравнительной прочности комплексных соединений на основании величин констант нестойкости можно делать только для однотипных соединений.
Одним из типичных комплексных соединений, отличающихся высокой устойчивостью и большой специфичностью роли металла, является гемоглобин. Гемоглобин, являясь слабой кислотой, входит в состав наиболее емкой буферной системы крови. Собственно комплексным соединением в гемоглобине является гем, входящий в структуру гемоглобина. Гем относится к группе металлопорфиринов, в которых центральным ионом является железо (II) с координационным числом 6. Хелатообразующим лигандом является тетрадентантный порфин. В координационной сфере железа (II) только 4 места заняты донорными атомами азота порфирина. Пятое место занимает донорный атом азота в радикале гистидина, связывающего гем с белковой частью молекулы – глобином. Шестое место является вакантным, его может занимать либо молекула О2 (образуется оксигемоглобин), либо молекула воды.
Оксид углерода (II) образует примерно в 300 раз более прочное, чем кислород, соединение с гемоглобином – карбоксигемоглобин. Токсичность угарного газа объясняется исходя из теории совмещенных лигандообменных равновесий: кислород и оксид углерода (II) конкурируют между собой за центральный ион – атом железа (II), находящийся в порфириновом комплексе.
Нарушение металло-лигандного гомеостаза возможно в следующих случаях:
· В организм поступают ионы – токсиканты из окружающей среды; наиболее опасные – ионы Hg(II), Cd(II), Tl(I). Все они способны образовывать прочные комплексы с биолигандами, серьезно нарушая параметры стационарного состояния.
· В организм поступают микроэлементы, необходимые для жизни, но в значительно больших количествах. Это обусловлено особенностью биогеохимических провинций (например, для Урала характерен избыток никеля).
· Нарушение металло-лигандного гомеостаза возможно и в результате недостаточного поступления важнейших микроэлементов (например, в Тюменской области – недостаток меди).
· Попадание из окружающей среды токсичных лигандов. Это средства химической защиты растений, моющие средства. Они содержат донорные атомы азота, серы, кислорода, фосфора, которые способны координироваться ионами биометаллов.
· В ряде случаев в организме образуются «фальшивые лиганды» (лигандная патология). Связанные «фальшивыми лигандами» ионы не могут образовывать жизненно необходимые биокомплексы.
В состав активных центров многих ферментов наряду с донорными атомами азота и кислорода входят атомы серы. При попадании в организм ионов тяжелых металлов возникает совмещенные равновесия и конкуренция процессов. Ионы Hg(II), Pb(II) и Tl(I) образуют с атомами серы более прочные соединения, чем ионы биометаллов. Ионы металлов-токсикантов выигрывая конкуренцию блокирует активные центры ферментов и выключают их из управления метаболизмом. Такие металлы называют тиоловыми ядами.
Выведение ионов тяжелых металлов из организма под действием хелатирующих реагентов называется хелатотерапией. Один из первых препаратов БАЛ (британский антилюзит). В настоящее время применяется унитиол (2,3-димеркаптопропансульфонат натрия). Он эффективно выводит из организма мышьяк, ртуть, хром, висмут. Для детоксикации организма при отравлениях свинцом используют препарат тетацин-кальций (CaNa2Y). Этот препарат применяют также для выведения кадмия, ртути, урана и редкоземельных металлов.
Основные термодинамические принципы хелатотерапии заключаются в двух положениях. Вводимый детоксикант:
а) должен эффективно связывать ионы - токсиканты; вновь образующиеся соединения должны быть прочнее, чем те, которые существовали в организме;
б) не должен разрушать жизненно необходимые комплексные соединения; соединения, которые могут образовываться при взаимодействии детоксиканта и ионов биометаллов, должны быть менее прочными, чем существующие в организме.
Почти все токсиканты (Hg, Pb, As, Cd) эффективно связывает сукцимер (димеркаптоянтарная кислота), он не выводит из организма ионы биометаллов. Этот препарат применяют в качестве антидота при отравлениях соединениями упомянутых металлов.
Препараты, способные вступать в реакции комплексообразования, используются для лечения различных заболеваний. Препараты золота (кризанол) применяются для лечения ревматоидного артрита. Цис- изомер дихлородиаммин платины (цис ДДП) применяется для лечения некоторых форм онкологических заболеваний.
Разбор типовых задач
1. Из раствора комплексной соли PtCl4×6NH3 нитрат серебра осаждает весь хлор в виде AgCl, а из раствора соли PtCl4×3NH3 – только ¼ часть входящего в ее состав хлора. Написать координационные формулы этих солей, определить координационное число платины в каждой из них.
Решение: Ионы серебра могут осаждать только те ионы хлора, которые связаны ионогенно с комплексным соединением, т.е. находятся во внешней сфере комплекса. В первом случае все 4 иона хлора находятся во внешней сфере:
[Pt(NH3)6]Cl4 + 4AgNO3 = 4AgCl¯ + [Pt(NH3)6](NO3)4
Во втором случае из четырех ионов хлора только один находится во внешней сфере, остальные три координарованы вокруг комплексообразователя Pt4+ и связаны ковалентной связью. Тогда состав комплекса будет иметь вид: [Pt(NH3)3Cl3]Cl. Реакция с AgNO3 протекает по схеме:
[Pt(NH3)Cl3]Cl + AgNO3 = AgCl¯ + [Pt(NH3)Cl3]NO3
В обоих комплексах Pt4+ имеет координационное число равное 6.
2. Константа нестойкости иона [Ag(NH3)2]+ составляет 9,3×10-8. Вычислите концентрацию ионов серебра в 0,05 молярном растворе [Ag(NH3)2]NO3, содержащем 0,5 моль/л NH3.
Решение: Вторичная диссоциация комплексного иона протекает по уравнению:
[Ag(NH3)2]+ « Ag+ + 2 NH3
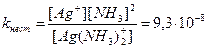
В присутствии избытка NH3 равновесие диссоциации сильно смещено влево. В таком случае можно принять, что [NH3] » 0,5 моль/л и [Ag(NH3) 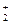 ] » » 0,05 моль/л.
] » » 0,05 моль/л.
Из выражения константы нестойкости имеем:
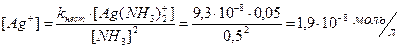
3. Установить, в каких случаях произойдет взаимодействие между растворами указанных электролитов. Написать уравнение реакций в молекулярной и ионно-молекулярной форме.
а) K2[HgJ4] + KBr ®
б) K2[HgCl4] + KCN ®
в) K[Ag(NO2)2] + NH3 ®
Решение:
а) Взаимодействие между комплексом и простым электролитом происходит, если при этом образуется более прочное комплексное соединение.
kнест = [HgJ4]2- = 1,5×10-30; kнест = [HgBr4]2- = 1×10-21.
Сравнивая эти величины видим, что йодидный комплекс более прочный, чем бромидный. Поэтому первая реакция не идет.
б) kнест = [Hg(CN)4]2- = 4,9×10-42; kнест = [HgCl4]2- = 8,5×10-16.
Как видно цианидный комплекс ртути (II) более прочный, чем хлоридный. Поэтому реакция идет слева направо.
K2[HgCl4] + 4KCN = K2[Hg(CN)4] + 4KCl
или [HgCl4]2- + 4CN- = [Hg(CN)4]2- + 4Cl-
в) kнест = [Ag(NO2)2] - = 1,8×10-3; kнест = [Ag(NH3)2]+ = 9,3×10-8.
Аммиачный комплекс более прочный, чем нитритный, поэтому реакция идет слева направо.
K[Ag(NO2)2] + 2NH3 = [Ag(NH3)2]NO2 + KNO2
или [Ag(NO2)2]- + 2NH3 = [Ag(NH3)2]+ + 2NO 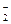
Лабораторная работа
Задание 1. Получение комплексных соединений.
· В пробирку налейте 1 мл раствора сульфата меди (II) и по каплям добавьте 10%-ный раствор аммиака. Наблюдайте выпадение осадка, а затем его растворение и изменение цвета раствора при образовании комплексного сульфата тетраамминмеди (II). Напишите уравнения реакции в молекулярном и ионно-молекулярном видах и выражение константы нестойкости.
· В пробирку с 0,5 мл раствора нитрата висмута прибавьте по каплям йодид калия до выпадения темно-бурого осадка йодида висмута. Добавляя избыток калия йодида растворите полученный осадок. Напишите уравнение реакции и выражение константы нестойкости полученного комплекса и назовите его.
· В две пробирки внесите по 0,5 мл раствора FeCl3. Одну оставьте для контроля, в другую по каплям прибавьте раствор щелочи до выпадения осадка Fe(OH)3. К образовавшемуся осадку добавьте 1 мл раствора щавелевой кислоты. Наблюдайте растворение осадка и цвет раствора. Затем в контрольную пробирку и в пробирку, где находится оксалатный комплекс Fe(III) добавьте 1-2 капли 0,01 М раствора роданида калия. В обеих ли пробирках наблюдается окрашивание? Напишите уравнения протекающих реакций и покажите строение внутрикомплексного соединения. Почему такие соединения называют хелатами? Какой комплекс Fe(III) прочнее: оксалатный или роданидный? Из справочника возьмите величины констант нестойкости и объясните, почему при добавлении KCNS к оксалатному комплексу раствор не окрасился?
Задание 2. Диссоциация и разрушение комплексных соединений.
В пробирку налейте 5 капель 0,1%-ного раствора AgNO3, добавьте равное количество раствора NaCl. Наблюдайте образование белого творожистого осадка. К образовавшемуся осадку добавьте 0,5 мл 10%-ного раствора аммиака. Наблюдайте растворение осадка. Напишите уравнение реакции образования комплекса и его диссоциацию. Выразите константу нестойкости и назовите комплексное соединение.
В пробирку с полученным комплексом по каплям добавьте HNO3 до выпадения осадка. Почему разрушилось комплексное соединение? Для объяснения этого явления пользуйтесь величинами констант нестойкости: kнест[Ag(NH3)2]+ = 9,3×10-8 и kнест[NH 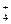 ] = 5,6×10-10.
] = 5,6×10-10.
Задание 3. Изучение окислительно-восстановительных свойств комплексных ионов.
· В пробирку налейте 1 мл раствора K4[Fe(CN)6], добавьте равный объем серной кислоты. К полученному раствору по каплям добавляйте раствор KMnO4. Наблюдайте обесцвечивание KMnO4. Реакцией с FeSO4 докажите образование комплекса K3[Fe(CN)6]. Напишите молекулярное уравнение реакции и уравняйте методом электронного баланса.
· Получите комплексное соединение [Ag(NH3)2]Cl как было указано в задании 2. К этому раствору опустите кусочек металлического цинка. Через 3 минуты достаньте кусочек и обратите внимание на его цвет. Какая реакция протекала между металлическим цинком и комплексом? Напишите уравнение реакции и объясните протекание этой реакции исходя из стандартных потенциалов систем: 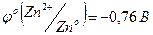 ;
; 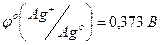 (для аммиачного комплекса).
(для аммиачного комплекса).
Ситуационные задачи для контроля усвоения темы
1. Напишите формулы следующих комплексных соединений: гексанитрокобальтат (III) калия; бромид гексаамминникеля (II); дибромодихлороаурат (III) магния; хлорид этилендиаминплатины (II); динитродиамминкобальт (II) калия.
2. Назвать следующие комплексные соединения: [Pd(H2O)(NH3)2Cl]Cl; [Co(NH3)5SO4]NO3; K2[Co(NH3)2(NO2)4]; K2[Pt(OH)5Cl]; [Cu(NH3)2(CNS)2]; [Pt(NH3)2Cl4].
3. Установите (пользуясь константами нестойкости комплексов), в каких случаях произойдет взаимодействие между растворами электролитов:
· K[Ag(CN)2] + NH3 ®
· [Ag(NH3)2]Cl + K2S2O3 ®
· K2[HgJ4] + KCN ®
4. Вычислите концентрацию иона цинка в растворе тетрацианоцинката натрия с концентрацией 0,1 моль/л при избытке цианид-ионов, равном 0,3 моль/л, если константа нестойкости комплекса равна 2,4×20-20.
5. Вычислите массу серебра, содержащегося в виде ионов в растворе хлорида диамминсеребра (I) с концентрацией 0,01 моль/л объемом500 мл. Раствор содержит аммиак, концентрация которого 0,1 моль/л, kнест[Ag(NH3)2]+=9,3×10-8.
6. Константы нестойкости комплексных ионов [Zn(NH3)4]2+ и [Zn(CN)4]2- составляют: 2×10-9 и 1×10-19. В каком из комплексов концентрация ионов Zn2+ больше, если комплексные ионы имеют одинаковую концентрацию – 0,001 моль/л?
7. Вычислите концентрацию иона ртути (II) в растворе тетраамминртути с концентрацией 0,1 моль/л при избытке NH3, равном 0,5 моль/л и kнест[Hg(NH3)4]2+=5×10-20.
8. Во сколько раз уменьшается концентрация ионов кадмия в растворе нитрата кадмия с концентрацией 0,1 моль/л после введения 0,4 моль/л аммиака (kнест[Cd(NH3)4]2+ = 2,8×10-7)?
9. Рассчитайте массу золота, находящегося в виде ионов в 100 мл раствора дицианоаурата (I) калия с концентрацией 0,01 моль/л при избытке цианида калия, равном 0,1 моль/л (kнест[Au(CN)2]-=5×10-30).
10. При какой концентрации Na2S начнет выпадать осадок из раствора тетрацианокадмиата (II) калия с концентрацией 0,1 моль/л, содержащего избыток цианид-ионов, равный 0,5 моль/л? kнест[Cd(CN)4]2- = 7,8×10-18; ПРCdS = 8×10-27.
Домашнее задание
Тема: «Электрохимические методы исследования. Потенциометрия».
Литература: [1] с. 464; [3] с. 156; [4] с. 85.
Дополнительная:
1. Пономарев В.Д. Аналитическая химия. Кн.2. М., Высшая школа. 1982.
2. Харитонов Ю.Я. Аналитическая химия. Аналитика. Кн.2. М., Высшая школа. 2002.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАНЯТИЕ №15 | | | ЗАНЯТИЕ №17 |
Дата добавления: 2014-09-10; просмотров: 2037; Нарушение авторских прав

Мы поможем в написании ваших работ!