
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЗАНЯТИЕ №18
Тема: Рубежная контрольная работа по IV блоку.
Учебные цели: проверка усвоения материала по данному блоку.
Вид занятий: практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: справочники, калькуляторы, таблицы.
Содержание занятия
1. Решение ситуационных и расчетных задач.
2. Ответы на теоретические вопросы.
3. Защита одной из лабораторных работ
4. Подведение итогов занятия. Задание на дом: «Подготовка к итоговому тестированию».
Вопросы к рубежной контрольной работе по IV блоку
1. Укажите термодинамические и кинетические условия равновесия в системе твердое вещество – его насыщенный раствор.
2. Сформулируйте правило произведения растворимости. Из какого закона оно вытекает?
3. Приведите математическое выражение правила произведения растворимости для следующих электролитов: AgBr, PbCl2, Ca3(PO4)2 и AxBy.
4. По каким формулам можно рассчитать растворимость следующих электролитов: BaSO4, Ag2CrO4, BiJ3, Ca3(PO4)2 и АхВу?
5. Какие следствия вытекают из правила произведения растворимости? Сформулируйте их.
6. Как влияют присутствие одноименного иона на растворимость осадка? Приведите конкретный пример.
7. Приведите общую схему и конкретный пример, иллюстрирующие 2 конкурирующие гетерогенные процессы: конкуренция за анион и конкуренция за катион.
8. При каких условиях одно малорастворимое соединение переходит в другое малорастворимое соединение?
9. При каких случаях на растворимость труднорастворимого соединения оказывает влияние рН среды? Покажите на примерах и объясните это явление.
10. Влияет ли природа растворителя, температура и посторонние вещества на растворимость труднорастворимого электролита? Чем это объясняется?
11. Приведите примеры гетерогенных процессов, протекающих в живых системах при норме и патологии.
12. Как объяснить, почему радионуклид стронция-90 легко включается в состав костной ткани? Чем это опасно для организма?
13. В растворе имеются ионы Pb2+ и Ва2+. При введении какого аниона в системе будет наблюдаться: а) изолированное гетерогенное равновесие, б) совмещенное гетерогенное равновесие? Какой из двух конкурирующих процессов будет преобладать в случае (б)?
14. К насыщенному водному раствору AgBr добавили: а) раствор NaCl; б) раствор KJ. Опишите возможные изменения в обоих случаях.
15. В чем различие простых и комплексных соединений?
16. В чем сущность координационной теории А. Вернера чем сущность координационной теореии А. ненийных ионовкомплексообразования в медицинеивости или нестойкости комплексного иона;?
17. Классификация комплексных соединений: а) по заряду комплексного иона, б) по природе лиганда.
18. Внутрикомплексное соединения (хелаты).
19. Константы устойчивости и нестойкости комплексных соединений. Связь между ними.
20. Лигандообменные процессы в жизнедеятельности и их значение.
21. Понятие о металло-лигандном гомеостазе.
22. Понятие о хелатотерапии и ее применение.
23. Приведите примеры биокомплексных соединений, содержащих железо, кобальт, цинк.
24. Напишите формулы следующих комплексных соединений: гексанитрокобальтат (III) натрия; хлорид гексаамминникеля (II); дибромодихлороаурат (III) кальция; сульфат бромопентааминкобальта (III); хлорид дихлородиамминплатины (IV).
25. Возможно ли в стандартном состоянии замещение лигандов: а) в тетрацианоцинканат-ионе на аммиак; б) в динитроаргентат-ионе на цианид-ион; в гексацианоферрат (III)-ионе на фторид-ион? Ответ подтвердите, пользуясь справочными данными.
26. Напишите уравнения диссоциации комплексных соединений: K3[Co(NO2)6]; [Ni(NH3)6]SO4; [Co(NH3)4Cl2]SO4; Mg[Pt(CN)4]. Приведите выражения полных констант нестойкости комплексных ионов.
27. Что называют редокс-системой? Приведите примеры двух разных редокс-систем, в состав которых входят: а) Fe2+; б) NO 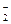 ; в) Н2О2.
; в) Н2О2.
28. Что называют стандартным и формальным редокс-потенциалом?
29. Какие факторы влияют на величину редокс-потенциала?
30. Объясните, почему нитрат-ион не окисляет ион Fe(II) в растворе с рН=7, но окисляет в растворе с рН=1.
31. Приведите примеры редокс-процессов в живых системах, сопровождающихся изменением степени окисления d-элементов.
32. Приведите примеры измерительных электродов, используемых для: а) потенциометрического определения рН; б) определения концентраций ионов кальция в крови.
33. Какие требования предъявляются к электродам сравнения? Приведите примеры двух электродов сравнения.
34. Приведите схему гальванического элемента составленного для измерения рН.
35. Опишите устройство стеклянного электрода.
36. Как практически определяют величину редокс-потенциала?
37. Какие процессы происходят на электродах гальванического элемента: Zn/Zn2+//Cu2+/Cu0, если 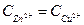 =1 моль/л? В каком направлении перемещаются электроны во внешней цепи?
=1 моль/л? В каком направлении перемещаются электроны во внешней цепи?
Типовые задачи к рубежной контрольной работе по IV блоку
1. В пробирке находится смесь 0,1 М растворов: хлорида натрия, бромида калия и йодида калия. Постепенно по каплям к этой смеси добавляют 0,1% раствор нитрата серебра. В какой последовательности будут выпадать осадок соли? Ответ объяснить пользуясь величинами ПР соответствующих солей.
2. Возможен ли перевод PbSO4 в PbS? В чем визуально это выражается? Возможен ли перевод PbS в PbSO4?
3. В растворе имеются фосфат- и хлорид- ионы. При введении какого катиона будут наблюдаться: а) выпадение в осадок только одного иона; б) выпадение в осадок обоих ионов?
4. В растворе имеются ионы магния и кальция. При введении какого аниона в системе будет наблюдаться: а) изолированное гетерогенное равновесие; б) совмещенное гетерогенное равновесие? Какой из двух конкурирующих процессов будет преобладать в случае (б)?
5. К насыщенному водном раствору SrSO4 добавили: а) раствор Ca(NO3)2; б) раствор Ba(NO3)2. Опишите возможные изменения в обоих случаях и объясните их.
6. Сколько грамм ионов Ag+ находится в 10 л насыщенного раствора AgBr (ПР=5,3×10-13).
7. Раствор карбоната калия с концентрацией 0,001 М находится в контакте с осадком карбоната кальция. Чему равна концентрация ионов кальция в жидкости над осадком? Вычислите массу кальция, находящегося в виде ионов в 0,5 л такой жидкости.
8. Раствор ацетата кальция приготовили смешением соли массой 1 г с водой 350 мл. Этот раствор смешали с раствором сульфата натрия с концентрацией 0,025 моль/л, причем объемы смешиваемых растворов были равны между собой. Образуется ли осадок в этих условиях?
9. Смешали 100 мл 2%-ного раствора K2SO4 (r=1,02) и 150 мл 5%-ного раствора Pb(NO3)2 (r=1,04). Выпадет ли осадок?
10. При какой концентрации СО 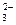 -ионов образуется осадок из 0,5 моль/л раствора Ca(NO3)2?
-ионов образуется осадок из 0,5 моль/л раствора Ca(NO3)2?
11. Вычислите массу Pb(NO3)2, которую надо добавить к водному раствору Na2CO3 с концентрацией 0,01 моль/л объемом 200 мл, чтобы получить осадок.
12. Какой концентрации ионов Ва2+ следует достичь, чтобы из насыщенного водного раствора СаSO4 выпал осадок ВаSO4?
13. Напишите формулы следующих комплексных соединений: гексанитрокобальтат (III) калия; бромид гексаамминникеля (II); дибромодихлороаурат (III) магния; хлорид этилендиаминплатины (II); динитродиамминкобальт (II) калия.
14. Назвать следующие комплексные соединения: [Pd(H2O)(NH3)2Cl]Cl; [Co(NH3)5SO4]NO3; K2[Co(NH3)2(NO2)4]; K2[Pt(OH)5Cl]; [Cu(NH3)2(CNS)2]; [Pt(NH3)2Cl4].
15. Установите (пользуясь константами нестойкости комплексов), в каких случаях произойдет взаимодействие между растворами электролитов:
· K[Ag(CN)2] + NH3 ®
· [Ag(NH3)2]Cl + K2S2O3 ®
· K2[HgJ4] + KCN ®
16. Вычислите концентрацию иона цинка в растворе тетрацианоцинката натрия с концентрацией 0,1 моль/л при избытке цианид-ионов, равном 0,3 моль/л, если константа нестойкости комплекса равна 2,4×20-20.
17. Вычислите массу серебра, содержащегося в виде ионов в растворе хлорида диамминсеребра (I) с концентрацией 0,01 моль/л объемом 500 мл. Раствор содержит аммиак, концентрация которого 0,1 моль/л, kнест[Ag(NH3)2]+=9,3×10-8.
18. Константы нестойкости комплексных ионов [Zn(NH3)4]2+ и [Zn(CN)4]2- составляют: 2×10-9 и 1×10-19. В каком из комплексов концентрация ионов Zn2+ больше, если комплексные ионы имеют одинаковую концентрацию – 0,001 моль/л?
19. Вычислите концентрацию иона ртути (II) в растворе тетраамминртути с концентрацией 0,1 моль/л при избытке NH3, равном 0,5 моль/л и kнест[Hg(NH3)4]2+=5×10-20.
20. Во сколько раз уменьшается концентрация ионов кадмия в растворе нитрата кадмия с концентрацией 0,1 моль/л после введения 0,4 моль/л аммиака (kнест[Cd(NH3)4]2+ = 2,8×10-7)?
21. Рассчитайте массу золота, находящегося в виде ионов в 100 мл раствора дицианоаурата (I) калия с концентрацией 0,01 моль/л при избытке цианида калия, равном 0,1 моль/л (kнест[Au(CN)2]-=5×10-30).
22. При какой концентрации Na2S начнет выпадать осадок из раствора тетрацианокадмиата (II) калия с концентрацией 0,1 моль/л, содержащего избыток цианид-ионов, равный 0,5 моль/л? kнест[Cd(CN)4]2- = 7,8×10-18; ПРCdS = 8×10-27.
23. Пользуясь таблицей стандартных потенциалов оставьте схемы двух гальванических элементов в одном из которых медь служила бы катодом, а в другом – анодом. Напишите уравнения реакций, происходящих при работе этих элементов и вычислите значения стандартных ЭДС.
24. Вычислить потенциал водородного электрода, погруженного:
а) в чистую воду;
б) в раствор с рН=3,5;
в) в раствор с рН=10,7.
25. ЭДС гальванического элемента, составленного из двух водородных электродов, равна 273 мВ. Чему равен рН раствора, в котором погружен анод, если катод погружен в раствор с рН=3?
26. Определите, возможна ли реакция между KMnO4 и KBr в растворе с рН=2, если концентрации равны: калия перманганата 0,01 моль/л, MnSO4 – 0,001 моль/л, бромид-иона и брома по 0,01 моль/л. Т=298о К.
27. Концентрации лактат- и пируват- ионов в буферном растворе (рН=7) равны между собой. Как изменится потенциал при окислении 1/10 части лактат- ионов до пируват- ионов?
28. Гальванический элемент составлен из двух водородных электродов, погруженных в растворы ацетата натрия и хлорида аммония с концентрациями по 1,0 моль/л. Вычислите ЭДС цепи при 298о К.
29. Вычислите при 310о К потенциал водородного электрода погруженного в слюну с рН=6,3. Давление газообразного водорода равно 101,3 кПа.
30. Вычислите стандартное значение ЭДС при 25о С гальванического элемента, составленного из серебряного и хлорсеребряного электродов. Какой процесс протекает на аноде?
31. Для измерения рН крови составлена гальваническая цепь из нормального каломельного и водородного электродов. Вычислите диапазон возможных значений ЭДС составленной цепи (Т=310о К).
32. Для измерения рН слезной жидкости была составлена гальваническая цепь из водородного и насыщенного хлорсеребряного электродов. Измеренная при 25о С ЭДС составила 0,705 В. Вычислите рН слезной жидкости.
33. Для сульфата бария величина произведения растворимости равна 1×10-10. Чему равна молярная растворимость этой в его насыщенном растворе? Сколько мг соли содержится в 500 мл этого раствора?
34. Смешали равные объемы 0,001 М раствора хлорида калия и 0,5% раствор нитрата серебра. Выпадет ли при этих условиях осадок хлорида серебра, если ПРAgCl = 1,8×10-10?
35. Вычислите концентрации иона цинка в растворе тетрацианоцинката натрия с концентрацией 0,01 моль/л, если цианид-ионы имеют концентрацию 0,3 моль/л, а константа нестойкости комплекса равна 2,4×10-20.
36. Константа нестойкости комплексного иона [Ag(NH3)2]+ равна 6×10-8. Рассчитайте концентрацию ионов комплексообразователя в 0,001 М растворе.
37. Приготовлен раствор объемом 1 л смешением воды с 0,2 моль нитрата серебра и 0,5 моль аммиака. Вычислите концентрацию ионов серебра в этом растворе, если kнест комплекса равен 6×10-8.
38. Вычислите рН слюны, если потенциал водородного электрода при 298о К равен -372 мВ.
Образец I части билета рубежного контроля по IV блоку
1. Влияние одноименных ионов на растворимость осадка. Показать на примерах.
2. Внутрикомплексные соединения (хелаты).
3. Электроды в потенциометрии. Измерительные электроды и электроды сравнения.
Образец II части билета рубежного контроля по IV блоку
1. Сколько грамм ионов Ag+ находится в 10 л насыщенного раствора AgBr, если ПР=5,3×10-13.
2. Во сколько раз уменьшается концентрация ионов кадмия в растворе нитрата кадмия с концентрацией 0,1 моль/л после введения 0,4 моль/л аммиака, если kнест[Cd(NH3)4]2+=2,8×10-7.
3. Вычислить потенциал водородного электрода, погруженного в раствор с рН=3,5.
Домашнее задание
«Подготовка к итоговому тестированию».
Литература: «Сборник тестовых заданий для итогового тестирования».
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Основная:
1. Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медвузов./ Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. Под ред. Ю.А. Ершова. –М., Высшая школа, 2003.
2. Биккулова А.Т., Ишмуратова Г.М. Биоэлементология s-, p- и d – элементов. –С.- Петербург, Наука, 1999.
3. Глинка Н.Л. Задачи и упражнения по общей химии. –М., Интеграл-Пресс, 2001.
4. Данное руководство.
Дополнительная:
5. Лекции по курсу общей химии.
6. Ахметов Н.С. Общая и неорганическая химия. –М., Высшая школа, 2002.
7. Пономарев В.Д. Аналитическая химия. Кн. 2. –М., Высшая школа, 1982.
8. Харитонов Ю.Я. Аналитическая химия. Аналитика. Кн. 2. –М., Высшая школа, 2002.
9. Краткий справочник физико-химических величин. Под ред. А.А. Равделя. –Л., Химия, 1983.
10. Чанг Р. Физическая химия с приложениями к биологическим системам. –М., Мир, 1980.
11. Неорганическая биохимия. Т. 1 и 2. Под ред. Г. Эйхгорна. М., Мир, 1978.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАНЯТИЕ №17 | | | КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ |
Дата добавления: 2014-09-10; просмотров: 809; Нарушение авторских прав

Мы поможем в написании ваших работ!