
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно – восстановительными реакциями (ОВР) называют реакции протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Степенью окисления элемента в соединении называют формальный заряд атома элемента, вычисленный из предположения, что валентные электроны переходят к атомам с большей относительной электроотрицательностью (ОЭО) и все связи в молекуле соединения являются ионными.
Степень окисления элемента указывается вверху над символом элемента со знаком «+» или (–) перед цифрой. Степень окисления элемента рассчитывается из положения, что сумма степеней окисления элементов в соединении равна нулю.
В окислительно – восстановительных реакциях протекают два взаимосвязанных процесса: окисление и восстановление. Вещества, атомы или ионы, которые отдают электроны, называются восстановителями, процесс отдачи электронов называется окислением. Таким образом, восстановители в ОВР окисляются. Алгебраическая величина степени окисления восстановителя повышается. Вещества, атомы или ионы которых присоединяют электроны, называются окислителями, процесс присоединения электронов называется восстановлением. Окислители в ОВР восстанавливаются. В результате процесса восстановления алгебраическая величина степени окисления окислителя понижается.
Важнейшими восстановителями являются:
а) все простые вещества металлы, наиболее активные восстановители – щелочные и щелочноземельные металлы.
б) сложные вещества, молекулы, которых содержат элементы в низшей степени окисления – метан CH4, силан SiH4, аммиак NH3, фосфин PH3, нитриды и фосфиды металлов (Na3N Ca3P2) , сероводород H2S, галогенводороды (HI, HCI, HBr) галогениды металлов, гидриды металлов (NaH, CaH2).
Важнейшими окислителями являются:
а) простые вещества – неметаллы с наибольшим значением электроотрицательности - фтор F2, кислород O2, хлор CI2.
б) сложные вещества, молекулы которых содержат элементы в высшей степени окисления – перманганат калия KMnO4, бихромат калия K2Cr2O7, азотная кислота HNO3, и ее соли нитраты, концентрированная серная кислота H2SO4, оксид свинца (IV) PO2, хлорная кислота HCIO4 и ее соли перхлораты и др.
Вещества, содержащие атомы в промежуточных степенях окисления могут как восстановителями (при действии более активного, чем они окислителя), так и окислителями (при действии более активного, чем они восстановителя) е вещества проявляют окислительно – восстановительную двойственность.
Окислители чрезвычайно токсичны для организма.
ТИПЫ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
1) Межмолекулярные окислительно – восстановительные реакции, окислитель и восстановитель входят в состав молекул различных веществ.
+4 +7 +6 +2
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5 Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Na2SO3 - восстановитель, сера меняет степень окисления от +4 до +6
KMnO4 –окислитель, марганец меняет степень окисления с +7 до +2
2) внутримолекулярные окислительно – восстановительные реакции.
В этих реакциях и окислитель и восстановитель входят в состав одного и того же вещества.
_-3 +6 0 +3
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Восстановитель азот, меняет степень окисления от -3 до 0,
окислитель хром, меняет степень окисления от +6 до +3.
3) реакции диспропорционирования, при которых один и тот же элемент, находящийся в промежуточной степени окисления является и окислителем и восстановителем.
0 -1 +1
2CI2 + 2Ca(OH)2 = CaCI2 + Ca(CIO)2 + 2H2O
CОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Для составления уравнений окислительных – реакций используется метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которое отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
 Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой.
Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой.
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
а) Определяем степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
+1 +7 -2 +1 -1 +1 +6 -2 +2 +6 -2 0 +1 +6 -2 +1 -2
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
б) Находим элементы, которые изменяют степени окисления, это марганец и бром:
+7 -1 +2 0
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
в) Составляем уравнения процессов окисления и восстановления:
Mn +7 + 5e = Mn+2 восстановление окислителя
2Br-1 - 2e = Br2 окисление восстановитель
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые количество отданных и принятых электронов будут равны;
Mn +7 + 5e = Mn+2 |2 
2Br-1 - 2e = Br2 | 5
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие процессах окисления и восстановления:
2KMnO4 + 10KBr + H2SO4 = 2MnSO4 + 5Br2 + K2SO4 + H2O
е) Уравниваем число атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода:
2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
Проверяем правильность уравнивания по равенству числа атомов кислорода в левой (40 атомов) и правой (40 атомов) частях уравнения.
ЭЛЕКТРОЛИЗ
Электролизом называется окислительно – восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Заряженные ионы электролита под действием электрического тока начинают двигаться к электродам: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются.
Электролиз расплавов и растворов протекает по разному т.к. в растворах дополнительно присутствуют ионы Н+ и ОН- , которые также участвуют в процессе электролиза.
Электролиз расплава. В теоретическом плане простейшим примером электролиза является электролиз расплава. Рассмотрим процесс электролиза расплава NaCI
NaCI = Na+ + CI–
Под действием электрического тока катионы движутся катоду и принимают от него электроны:
Катод (—) Na+ + e = Na0 – процесс восстановления.
Анионы CI– движутся к аноду и отдают электроны:
Катод (—) 2 CI– - 2е = CI2  - процесс окисления.
- процесс окисления.
Na+ + e = Na0
2 CI– — 2е = CI2 
Суммарное ионное уравнение электролиза: 2Na+ + 2 CI– = 2Na0 + CI2 
Суммарное молекулярное уравнение: 2NaCI = 2Na + CI2 
На катоде выделяется металлический натрий, на аноде – газообразный хлор. Это реакция окислительно - восстановительная, на катоде всегда идет процесс восстановления, на аноде всегда идет процесс окисления.
Электролиз растворов. Процесс на катоде.
1.Если катион электролита находится в начале электрохимического ряда (по AI включительно), то на катоде идет процесс восстановления воды (выделяется Н2). Катионы металла не восстанавливаются, остаются в растворе.
2.Если катион электролита находится в ряду между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла и молекулы воды.
3.Если катион электролита находится в ряду напряжения после водорода, то на катоде идет только процесс восстановления ионов металла.
4.Если в растворе находится смесь катионов разных металлов, то первыми восстанавливаются катионы менее активных металлов.
Катодные процессы в водных растворах солей
| Li, K, Ca, Na, Mg, Al | Mn, Zn, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
| Men+ - металл не востанавливается | Men+ + Me0 | Men+ +2e = Me0 | |
2Н2О + 2е = Н2  + 2ОН— + 2ОН—
| 2Н2О + 2е = Н2  + 2ОН— + 2ОН—
|
Процесс на аноде. Продукты электролиза зависят от материала анода и природы аниона.
1. Если анод растворимый (железо, медь, серебро), то независимо от природы аниона всегда идет окисление металла анода.
2. Если анод нерастворимый (уголь, графит, платина, золото), то анионы безкислородных кислот (за исключением фторидов) окисляются на аноде, а анионы оксокислот и фториды не окисляются на аноде, а идет окисление воды с выделением кислорода. При электролизе щелочей идет окисление гидроксид ионов.
Анодные процессы в водных растворах
| Анод | Анионы безкислородные | Анионы кислородсодержащие |
| Нерастворимый | Окисление аниона (кроме фторидов) Асm — +me = Ас0 | В щелочной среде
4ОН—— 4е = О2  + 2Н2О
В кислой, нейтральной средах
2Н2О — 4е = О2 + 2Н2О
В кислой, нейтральной средах
2Н2О — 4е = О2  + 4Н+ + 4Н+
|
| Растворимый | Окисление металла анода Ме0 —ne = Меn+ Анод раствор | Окисление металла анода Ме0 —ne = Меn+ Анод раствор |
Массу вещества, образовавшегося при электролизе найти исходя из закона Фарадея:
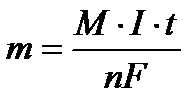 , где m - масса вещества, М – молярная масса, n - количество отданных или принятых электронов, F – число Фарадея (96500 Кл/моль) = А·ч/моль), I – сила тока (А), t - продолжительность процесса.
, где m - масса вещества, М – молярная масса, n - количество отданных или принятых электронов, F – число Фарадея (96500 Кл/моль) = А·ч/моль), I – сила тока (А), t - продолжительность процесса.
Электролиз используется для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний, натрий, кадмий получают только электролизом. Очистку меди, никеля, свинца проводят целиком электрохимическим методом. Для защиты от коррозии электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла (хрома, серебра, меди, никеля, золота), устойчивого к коррозии.
ХИМИЧЕСКИЕ ИСТОЧНИКИ ЭЛЕКТРИЧЕСКОЙ ЭНЕРГИИ
Устройства, которые применяют для непосредственного преобразования энергии химических реакций в электрическую энергию, называют гальваническими элементами или химическими источниками электрической энергии. Действие любого гальванического элемента основано на протекании в нем окислительно – восстановительной реакции.
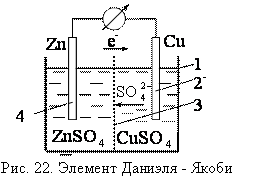
Классический пример гальванического элемента – элемент Даниэля – Якоби, он состоит из цинковой пластины (1), погруженной в раствор сульфата цинка и медной пластины (2), погруженной в раствор сульфата меди. Растворы разделены пористой перегородкой (4) (или электролитическим мостиком).
При замкнутой цепи цинк окисляется, ионы цинка переходят в раствор, электроны движутся по внешней цепи к медному электроду.
На медном электроде происходит восстановление ионов меди из раствора, медь выделяется на пластинке. Цинковый электрод является анодом, медный катодом, цинк растворяется, медь выделяется из раствора, сульфат анионы движутся через пористую перегородку от медного к цинковому электроду.
Процесс на аноде Zn = Zn+2 + 2e
Процесс на катоде Cu+2 + 2e = Cu
Суммарное уравнение: Zn + Cu+2 = Zn+2 + Cu
Молекулярное уравнение: Zn + CuSO4 = Zn SO4 + Cu
Кратко строение элемента Даниэля – Якоби можно записать следующей схемой:
Zn|ZnSO4(р) || CuSO4(р)|Cu
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. В настоящее время используются различные гальванические элементы: железо – никелевые, кадмиево – никелевые, серебряно – цинковые, свинцовые, и др. их называют аккумуляторами. В свинцовом аккумуляторе одни пластины заполнены дооксидом свинца, другие губчатым свинцом. Металлический свинец при работе аккумулятора является анодом и окисляется:
Pb + SO4-2 = PbSO4 +2e
Диоксид свинца является катодом, он восстанавливается:
PbO2 + SO4-2 + 4H+ + 2e = PbSO4 +2H2O
Суммарный процесс: Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
При зарядке, через аккумулятор пропускают электрический ток и в результате этого электрохимические процессы на электродах протекают в обратном направлении.
Свинцовый электрод становится катодом, на нем протекает процесс восстановления:
PbSO4 +2e = Pb + SO4-2
На электроде из PbO2 происходит процесс окисления:
PbSO4 + 2H2O = PbO2 + SO4-2 + 4H+ + 2e
 ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Электродвижущая сила гальванического элемента равна алгебраической сумме электродных потенциалов электродов.
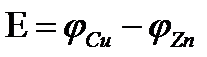


Скачок потенциала, возникающий на границе раздела металл – раствор его соли, называется электродным или окислительно – восстановительным потенциало ( 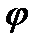 ). Зависимость электродного потенциала от природы металла, концентрации его ионов в растворе и температуры количественно выражается уравнением В. Нернста.
). Зависимость электродного потенциала от природы металла, концентрации его ионов в растворе и температуры количественно выражается уравнением В. Нернста. 
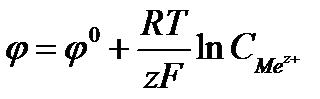 , где F - число Фарадея
, где F - число Фарадея
равно 96500Кл/моль, z – заряд иона, R – газовая постоянная 8,31Дж/моль·К, Т температура по Кельвину, 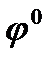 - стандартный электродный потенциал металла. Подставляя в формулу число Фарадея, температуру 298К, газовую постоянную и десятичный логарифм, получаем:
- стандартный электродный потенциал металла. Подставляя в формулу число Фарадея, температуру 298К, газовую постоянную и десятичный логарифм, получаем:
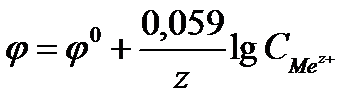
Стандартным электродным потенциалом металла 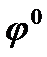 называется скачок потенциала на границе раздела металл - раствор его соли с концентрацией 1 моль/л.
называется скачок потенциала на границе раздела металл - раствор его соли с концентрацией 1 моль/л.
Для измерения электродных потенциалов собирают гальваническую цепь, состоящую из исследуемого электрода и стандартного водородного электрода. Водородный электрод представляет собой платиновую пластинку, насыщенную газообразным водородом, которая опущена в водный раствор кислоты. Потенциал стандартного водородного электрода принят равным нулю. Например: для цинкового электрода:
Zn|ZnSO4|| H2SO4 |H2,Pt
Потенциал цинкового электрода будет равен ЭДС такого гальванического элемента с обратным знаком, если берется медный электрод, то его потенциал будет равен ЭДС гальванического элемента.
Последовательность металлов, расположенных в порядке убывания (возрастания) значений их электродных потенциалов, называется рядом напряжения или рядом активности металлов. В гальванических элементах более активный металл является анодом (он растворяется при работе гальванического элемента), а менее активный катодом. Для расчета ЭДС гальванического элемента из потенциала менее активного металла отнимается потенциал более активного металла.
Например: стандартный потенциал цинкового электрода равен -0,76 В, медного 0,35В. ЭДС = 0,35 – (-0,76) = 1,11В.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
К электрохимической коррозии относятся все случаи коррозии в водных растворах или во влажной атмосфере. Для предупреждения от электрохимической коррозии применяются различные методы. Например, защитные металлические покрытия. Железные изделия могут покрываться тонкой пленкой хрома, никеля, цинка, кадмия, алюминия, олова, серебра, золота и др. При нарушении целостности металлического покрытия в влажной среде, возникает гальванический элемент, что приводит к растворению более активного металла. Металл, который в ряду напряжения стоит левее, становится анодом и разрушается, при этом менее активный металл не изменяется.
Для защиты металлов от коррозии используют как анодное, так и катодное покрытие металлов. При анодном покрытии берется более активный металл (например, покрытие цинком железного изделия), он и растворяется при коррозии, а основной металл не разрушается. Катодное покрытие (например, серебрение железного изделия), защищает металл до тех пор пока, пленка не нарушена. При нарушении защитной пленки основной металл становится анодом, а покрытие катодом, соответственно разрушается защищаемый металл, а покрытие не разрушается.
Обучающие задачи
Задача 1.Сумма коэффициентов в уравнении реакции:
Cu + HNO3 = Cu(NO3)2 + NO + H2O, составляет
1) 10 2) 15 3) 20 4) 18
Решение:
0 +5 +2 +2
Cu + HNO3 = Cu(NO3)2 + NO + H2O
Сu - 2e = Cu+2 | 3 Окисление восстановителя
N+5 + 3e = N+2 | 2 восстановление окислителя
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Ответ: 3
Задача 2. При электролизе водного раствора NaCI c нейтральными электродами протекает следующая окислительно – восстановительная реакция:
1) 2NaCI + 2Н2О = Н2  + CI2
+ CI2  + 2NaOH 2) 2NaCI = 2Na + CI2
+ 2NaOH 2) 2NaCI = 2Na + CI2 
3) NaCI + Н2О = НCI + NaOH 4) 2NaCI + 2Н2О = CI2  + 2NaOH
+ 2NaOH
Решение:
Катод (—) 2Н2О + 2е = Н2  + 2ОН— Анод (+) 2 CI– — 2е = CI2
+ 2ОН— Анод (+) 2 CI– — 2е = CI2 
Суммарное ионное уравнение: 2Н2О + 2 CI– = Н2 + 2ОН— + CI2 
электролиз
Суммарное молекулярное уравнение: 2NaCI + 2Н2О = Н2  + CI2
+ CI2  + 2NaOH Ответ: №1
+ 2NaOH Ответ: №1
Задача 3. Написать уравнения электролиза раствора Cu(NO3)2 c инертным анодом.
Решение: Катод (—) Сu2+ + 2е = Cu0 Анод (+) 2Н2О — 4е = О2  + 4Н+
+ 4Н+
Суммарное ионное уравнение: 2Сu2+ + 2Н2О = 2Cu0 + О2  + 4Н+
+ 4Н+
Суммарное молекулярное уравнение: 2 Cu(NO3)2 + 2Н2О = 2Cu0 + О2  + 4НNO3
+ 4НNO3
Задача 4.При прохождении через раствор нитрата серебра количества электричества величиной 48250 Кл на катоде образуется ____граммов чистого серебра. (F = 96500Кл/моль)
1) 27 2) 54 3) 18 4) 108
Решение: Можно рассчитать массу серебра по закону Фарадея 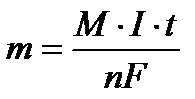 ; М(Ag = 108 г/моль, I ·t = 48250Кл, F = 96500Кл/моль
; М(Ag = 108 г/моль, I ·t = 48250Кл, F = 96500Кл/моль
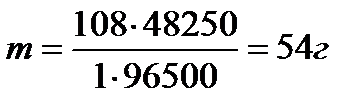
Ответ: 2
Задания для самостоятельной работы
При выполнении самостоятельной работы необходимо полностью приводить обоснования правильности выбора номера верного ответа (посмотрите примеры решения теста выше).
1) Согласно уравнению Нернста потенциал электрода______.
1) Зависит от его массы 2) Зависит от его природы
3) Не зависит от температуры 4) Не зависит от концентрации электролита
2) ЭДС гальванического элемента, состоящего из медного и цинкового электродов, погруженных в 0,01 М растворы их сульфатов
(Е0Сu2+/Cu=0,34B, Е0Zn2+/Zn=-0,76B) равна___ В.
1) 1,10 2) 0,70 3) 0.28 4)0,43
3) Если при электролизе водного раствора соли значение рН в катодном пространстве возросло, то электролизу подвергался раствор____.
1) Cu(NO3)2 2)KCl 3) CuCl2 4) ZnCl2
4) В гальваническом элементе, состоящем из никелевого 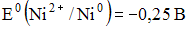 и железного
и железного 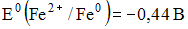 электродов, погруженных в 1 М растворы их солей, на аноде протекает процесс:
электродов, погруженных в 1 М растворы их солей, на аноде протекает процесс:
1) 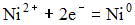 2)
2) 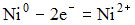
3) 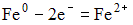 4)
4) 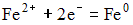
5) Сумма коэффициентов в суммарном уравнении процесса электролиза водного раствора AgNO3 равна___.
1) 11 2) 15 3) 3 4) 7
6) При электролизе раствора хлорида меди (II) на катоде выделилось 2,7 г меди. Объем газа (н.у.), выделившегося на аноде равен _______ л.
1) 4,48 2) 0,945 3) 2,24 4) 6,72
7) Сумма коэффициентов в левой части уравнения реакции KMnO4 + Na2SO3 + H2SO4®… составляет____.
1) 6 2) 8 3) 12 4) 10
8) При прохождении через раствор нитрата серебра количества электричества величиной 48250Кл на катоде образуется ___граммов чистого серебра (F=96500Кл/моль).
1) 27 2) 54 3) 18 4) 108
9) Коэффициент перед молекулой восстановителя в уравнении реакции KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O равен____.
1) 5 2) 3 3) 2 4) 1
10) Если гальванический элемент составлен из двух серебряных электродов, один из которых стандартный, то для достижения наибольшего ЭДС другой электрод следует погрузить в раствор AgNO3 c концентрацией____.
1) 0,5 М 2) 0,2 М 3) 0,4 М 4) 0,1 М
11) ЭДС гальванического элемента состоящего из железного и серебрянного электродов, погруженных в 0,1 М растворы их нитратов Е0(Fe+2/ Fe)= -0,44 В, Е0(Ag+/ Ag)= 0,80 В, равна_______В.
1) 1,21 2) 1,24 3) – 1,21 4)– 1,24
12) Для получения 54 г серебра электролизом водного раствора нитрата серебра (выход по току 100%), необходимо чтобы в растворе содержалось___граммов чистой соли.
1) 255 2) 85 3) 340 4) 170
13) При электролизе воды на аноде выделилось 11,2 л (н.у.) кислорода. Объем водорода, выделившегося на катоде равен ____ л (н.у.).
1) 22.4 2) 5.6 3) 44.8 4) 11.2
14) Если гальванический элемент составлен из двух электродов, один из которых стандартный цинковый электрод Е0 = -0,76В, то для достижения наибольшего значения Э.Д.С. другим электродом должен быть стандартный______.
1) медный Е0=+0,34 В 2) серебряный Е=+0,8 В
3)свинцовый Е=-0,13 В 4) водородный
15) Максимальное значение ЭДС (при одинаковых концентрациях солей) будет у гальванического элемента Ме|Me(NO3)2||Cu(NO3)2|Cu, если стандартный потенциал второго металла равен ___В.
1) – 0,76 2) – 2,36 3) + 1,19 4) +1,50
| <== предыдущая страница | | | следующая страница ==> |
| | | Основные уравнения химической термодинамики и химического равновесия |
Дата добавления: 2014-09-10; просмотров: 1397; Нарушение авторских прав

Мы поможем в написании ваших работ!