
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Основные уравнения химической термодинамики и химического равновесия
1. Q = DE + W -уравнение первого начала термодинамики
2. W = PDV –работа расширения
3. Qv = DEv -теплота изохорного процесса
4. Qp = DHp -теплота изобарного процесса
5. DHp = DE + PDV -уравнение первого начала термодинамики для изобарных процессов
6. DH = ånDH0 298 обр. прод. реак. - ånDH0 298 обр. исх. веществ - первое следствие закона Гесса
7. DH = ånDH0 298 сгор. исход. в. - ånDH0 298 сгор. прод. реакции- второе следствие закона Гесса
8. Q = W -уравнение первого начала термодинамики для биосистем
9. DS = Q / T ¾¾ -энтропия как функция состояния системы
10. DS ³ 0 -уравнение второго начала термодинамики
11. S = ånS0 298 прод. р. - ånS0 298 исх. в. -расчет энтропии реакции
12. DG0 = DH0 - TDS0 -уравнения для расчета энергии Гиббса
13. DG0 = ånDG0 298 прод. р. - ånDG0 298 исх. в. расчет энергии Гиббса по реакции
14. DG0 = - 2,3RT lg Кс- уравнение изотермы химической реакции при стандартных условиях
15. 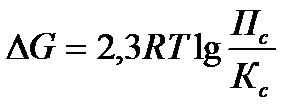 - уравнение изотермы химической реакции
- уравнение изотермы химической реакции
16. 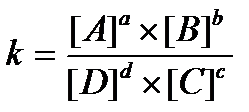 - константа химического равновесия, выраженная через равновесные концентрации вещества
- константа химического равновесия, выраженная через равновесные концентрации вещества
17. 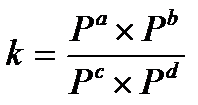 - константа химического равновесия, выраженная через равновесные парциальные давления вещества
- константа химического равновесия, выраженная через равновесные парциальные давления вещества
18. 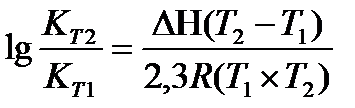 - уравнение изобары
- уравнение изобары
19. 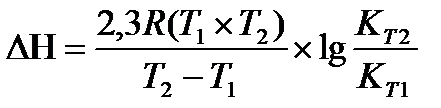 - расчет теплового эффекта по значениям констант
- расчет теплового эффекта по значениям констант
Таблица 1
Стандартные энтальпии образования веществ, стандартные энтропии и стандартные энергии Гиббса образования веществ
| Вещество | Стандартная энтальпия образования кДж/моль | Стандартная энтропия Дж/моль×К | Стандартная энергия Гиббса образования кДж/моль |
| Неорганические вещества | |||
| С (графит) | +6 | ||
| СО (г) | -110 | +198 | -137 |
| СО2 (г) | -393,5 | +214 | -394 |
| Cl2 (г) | +223 | ||
| Cl2O (г) | +76 | +266 | +94 |
| FeСО3 (тв) | -753 | +96 | -680 |
| H2 (г) | +131 | ||
| HCl (г) | -92 | +187 | -95 |
| HI (г) | +24 | +206 | -1 |
| HNO2 (р-р) | -119 | +153 | -56 |
| HNO3 (ж) | -174 | +156 | -81 |
| H2O (ж) | -286 | +70 | -237 |
| H2O2 (ж) | -187 | +110 | -120 |
| H2S (г) | -21 | +206 | -34 |
| H2SO4 (ж) | -814 | +157 | -690 |
| KNO3 (тв) | -495 | +133 | -395 |
| KOH(р-р) | -477 | +92 | -441 |
| N2 (г) | +192 | ||
| NH3 (г) | -46 | +192 | -16 |
| H2O (г) | +82 | +220 | +104 |
| NO (г) | +91 | +211 | +87 |
| NO2 (г) | +33 | +240 | +51 |
| N2O3 (г) | +11 | +356 | +115 |
| Na2O2 (тв) | -510 | +95 | -447 |
| Na2S2O3 (тв) | -1117 | +225 | -1043 |
| O2 (г) | +205 | ||
| SO2 (г) | -297 | +248 | -300 |
| SO3 (г) | -396 | +257 | -371 |
| Органические вещества | |||
| Метан (г) | -75 | +186 | -51 |
| Этан (г) | -85 | +229 | -33 |
| Этилен (г) | +52 | +219 | +68 |
| Ацетилен (г) | +227 | +201 | +209 |
| Бензол (ж) | +49 | +173 | +125 |
| Циклогексан (ж) | -156 | +204 | +27 |
| Хлорметан (г) | -86 | +234 | -63 |
| Дихлорметан (г) | -95 | +270 | -69 |
| Трихлорметан (г) | -101 | +296 | -69 |
| Тетрахлорметан (г) | -100 | +310 | -58 |
| Метанол (ж) | -239 | +127 | -166 |
| Этанол (ж) | -277 | +161 | -174 |
| Диэтиловый эфир (ж) | -279 | +253 | -123 |
| Ацетальдегид (г) | -166 | +264 | -133 |
| Ацетон (ж) | -247 | +199 | -154 |
| Пируват-ион (р-р) | + | -559 | |
| L-молочная кислота (р-р) | -686 | +222 | -539 |
| Сахароза (тв) | -2222 | +360 | -1545 |
| D-глюкоза (р-р) | -1264 | +269 | -917 |
| Нитробензол (ж) | +16 | +224 | +146 |
| Анилин (ж) | +31 | +191 | +149 |
| L-лейцин (р-р) | -643 | +208 | -362 |
| Глицин (р-р) | -523 | +159 | -380 |
| D,L-лейцилглицин (р-р) | + | -464 | |
| Глицилглицин (р-р) | -734 | +231 | -492 |
Стандартные энтальпии сгорания органических веществ, кДж/моль
| Метан (г) | -890 | Этанол (ж) | -1371 |
| Ацетилен (г) | -1300 | Диэтиловый эфир (ж) | -2727 |
| Бензол (ж) | -3268 | Нитробензол (ж) | -3091 |
| Циклогексан (ж) | -3920 | Анилин (ж) | -3396 |
| Метанол (ж) | -727 | Глюкоза | -2802 |
Удельная теплота полного окисления веществ в условиях организма, кДж/г.
| Условный белок | |
| Условный жир | |
| Углеводы |
Обучающие задачи
Задача 1.В организме человека реакция окисления этилового спирта протекает в две стадии. Первая - окисление этилового спирта до уксусного альдегида с участием фермента алкогольдегидрогеназы протекает по уравнению: С2H5OH + ½ O2 = CH3COH + H2O.
Рассчитайте DH0 реакции, используя первое следствие закона Гесса, если
DН0 обр.(C2H5OH) = - 278 кДж/моль;
DН0 обр.(CH3СOH) = - 166 кДж/моль;
DН0 обр.(H2O) = - 286 кДж/моль.
Решение: DH0 = å n DH0 обр.пр.р. - å n DН0 обр.исх.в.в; DH = (-166+ (-286)-(-278)) = - 174 кДж/моль
Ответ: тепловой эффект реакции DH = -174 кДж/моль, т.е. процесс экзотермический.
Задача 2.Теплота сгорания глюкозы равна -2810 кДж/моль, теплота сгорания этилового спирта равна -1366 кДж/моль. На основании этих данных вычислите тепловой эффект биохимического процесса брожения глюкозы:
С6Н12О6= 2С2Н5ОН + 2СО2
Решение: Тепловой эффект данной реакции можно рассчитать, применяя второе следствие из закона Гесса:
DН = ån DН0 сгор. исход. веществ - å n DH0 сгор. прод. реакции
DН = -2810 - 2 ∙(-1366) = - 78 кДж/моль
Ответ: тепловой эффект процесса брожения равен - 78 кДж/моль.
Задача 3.Рассчитайте стандартную энтропию реакции:
NH2 - CH2 - COOH + NH2 - CH2 - COOH → NH2 - CH2 - CO - NH - CH2 - COOH + H2O
глицин глицин глицилглицин
Если S0 (глицилглицина) = 231 Дж/моль×К;
S0 (глицина) = 159 Дж/ моль×К; S0( H2O) = 70 Дж/моль×К;
Решение:
DS = S0298(гл-гл) +S0298(H2O)– 2 S0 298(глицина) = (231+70)-(159+159)= -17 Дж/моль×К
Ответ:DS0 298= - 17 Дж/моль×К, т.е. энтропия уменьшится.
Задача 4.Теплота сгорания углеводов, белков и жиров составляет 17, 17 и 39 кДж
соответственно. Среднесуточная потребность в белках, жирах и углеводах для студентов - мужчин составляет 113, 106 и 451г. Какова суточная потребность студентов - мужчин в энергии?
Решение: Рассчитываем, сколько энергии выделяется при окислении углеводов, белков и жиров
DH = (451×17) + (113 × 17) + (106 × 39) = 13722 кДж.
Ответ: Суточная потребность в энергии равна 13722 кДж.
Задача 5. Почему процесс денатурации белка при 400С является самопроизвольным, если реакция эндотермическая и тепловой эффект составляет 2830 Дж/моль? Значение DS для данной реакции равно 288 Дж/моль∙К
Решение:Для определения направления процесса необходимо знать величину изменения энергии Гиббса, рассчитываемой по уравнению: DG0 = DH0 - TDS0. Расчет показывает, что DG < 0 ( DG0 = 2830 Дж/моль - (313К × 288 Дж/моль∙К) = - 87314 Дж/моль или - 87,3 кДж/моль).
Ответ: Поскольку DG < 0, то процесс денатурации белка при 400С протекает самопроизвольно, повышение температуры тела может представлять опасность для жизнедеятельности организма.
Задача 6. Вычислите энергию Гиббса, являющуюся критерием самопроизвольности процессов, для реакции гликолиза при стандартных условиях: С6H12О6 (р-р) ® 2С3H6О3 (р-р) (молочная кислота).
Решение:
Из таблицы термодинамических величин запишем стандартную энергию Гиббса для участников химического процесса: ∆G0 (С6H12О6) = -917 кДж/моль; ∆G0(С3H6О3) = -539 кДж/моль. Используя 1 следствие из закона Гесса вычислим энергию Гиббса:
ΔG0 = 2×ΔG0 (C3H6O3) - ΔG0 (C6H12O6)
ΔG0 = 2(-539) – (-917) = -161 кДж/моль
Ответ:т.к. ΔG0 < 0, то реакция протекает самопроизвольно в прямом направлении.
Задача 7. Вычислить изменение энергии Гиббса при 250С по стандартным значениям энтальпий образования и абсолютных энтропий для данной реакции: СО + 2Н2 = СН3ОН
DН0обрСН3ОН = -293 кДж/моль S0(СН3ОН) = 127 Дж/моль×К
DН0обрСО = - 110 кДж/моль. S0(CO) = 198 Дж/моль×К
S0(H2) = 131 Дж/моль×К
Решение: DG0 = DH0 - TDS0
DH0 = ånDH0обр. пр. реак. - ånDН0обр. исх. веществ
DН0 = - 293 - (-110) = - 183 кДж/моль
DS0 = å n S0 прод. р - å n S0 исход. веществ
DS0 = 127 - (198 + 2(131) = - 333 Дж/моль×К
DG0 = - 183,5 кДж/моль - (298К × 0,333 кДж/моль×К) = - 83,8 кДж/моль
Ответ: DG0 = - 83,8 кДж/моль
Задача 8.Рассчитайте константу равновесия при 310 К для реакции АТФ + АМФ↔2 АДФ, если свободная энергия Гиббса реакции ΔG°=-2,1 кДж/моль
Решение:в состоянии равновесия DG0 = - 2,3RT lg Кс
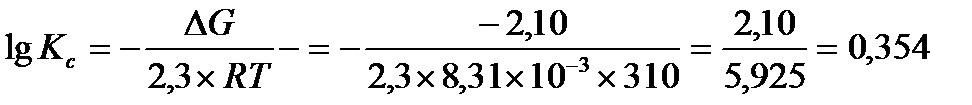
lgKc= 0,354
Kc= 100,354=2,26
Ответ: Kc = 2,26
Задача 9.Константа равновесия реакции: PCl5(г) « PCl3(г) + Cl2(г) при 2500С равна 2. В каком направлении идет реакция при следующих концентрациях: С(PCl5) = C(PCl3) = 2 моль/л; С(Сl2) = 4 моль/л ?
Решение: Для определения направления протекания реакции воспользуемся уравнением изотермы 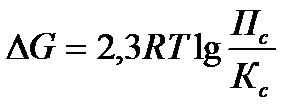
Рассчитаем Пс
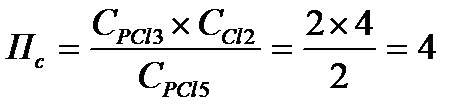
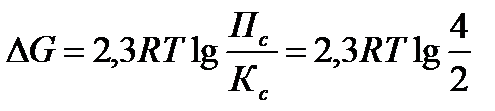
Т.к. Пс > Кс, то DG > 0
Вывод: реакция самопроизвольно протекать в прямом направлении не может, т.к. DG>0.
Задача 10.Константа равновесия реакции 2SO2 (г) + O2(г) Û 2SO3(г) при температуре 6270С равна 2,3∙10-7, DН0 = 376,5 кДж/моль. Рассчитайте константу равновесия при 7270С.
Решение: воспользуемся уравнением изобары химической реакции:
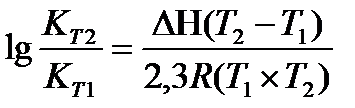
T1 = 273 + 627 = 900 K
T2 = 273 + 727 = 1000K
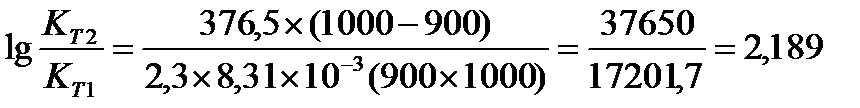
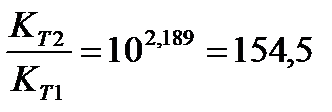

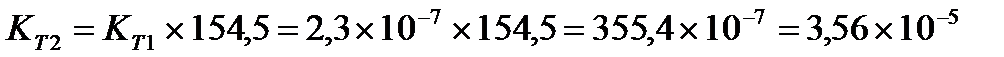

Ответ: Константа равновесия при 7270С равна 3,56 × 10-5 .
Задача 11.Для реакции Н2О(г) + СO(г) ® CO2(г) + H2(г) константы химического равновесия равны: при 8000С Кр = 2,87, при 10000С Кр = 1,39. Вычислите тепловой эффект этой реакции.
Решение: Применив, уравнение изобары химической реакции, рассчитаем DН
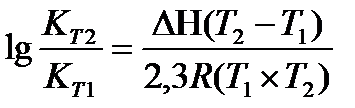
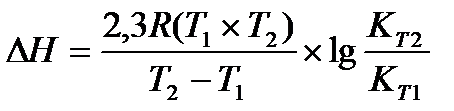
Перевёдём температуру в Кельвины: T1 = 800 + 273 = 1073 K
T2 = 1000 + 273 = 1273 K
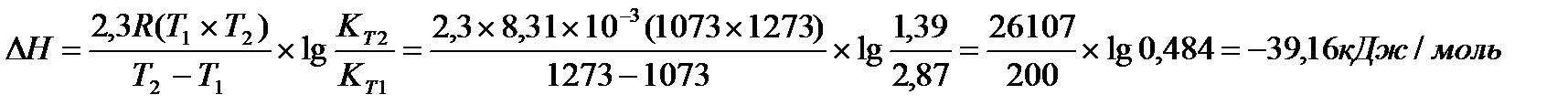 Ответ:DН = -39,16 кДж/моль.
Ответ:DН = -39,16 кДж/моль.
Задачи для самостоятельной работы
Задача 1.На испарение 1 моля воды требуется 40 кДж. Сколько теплоты будет потеряно за день при выделении через кожу 720г воды?
Ответ:1600 кДж
Задача 2.Пероксид водорода (Н2О2) в виде раствора с массовой долей 3 %. используется в медицине для обработки ран. Докажите, что процесс разложения пероксида водорода в присутствии фермента каталазы является самопроизвольным, используя для расчёта значения стандартной энтропии образования исходных веществ и продуктов реакции:
S0 298 (H2O2) =110 Дж/моль×К; S0 298 (Н2О) = 70 Дж/моль×К; S0298(O2) = 205 Дж/моль×К.
Ответ: ΔS = 62,5 Дж/моль × К
Задача 3. При сжигании метана объемом 2 м3 выделяется 79600 кДж теплоты. Рассчитайте стандартную теплоту сгорания метана.
Ответ: 891,52 кДж/моль
Задача 4. Рассчитайте стандартную энергию Гиббса для процесса окисления глюкозы по следующим данным: DН0обр (С6Н12О6) = - 1264,4 кДж/моль; DН0обр (СО2) = - 393 кДж/моль;
DН0обр (Н2О) = - 286 кДж/моль. Изменение энтропии всей реагирующей системы равно 0,259 кДж/моль×K
Ответ:DG = - 2886,8 кДж/моль.
Задача 5.Вычислите стандартную энтальпию образования этанола, воспользовавшись необходимыми для этого стандартными энтальпиями сгорания.
Ответ: DН0обр. = -273 кДж/моль
Задача 6.Константа равновесия реакции N2O4 (г) ↔ 2 NO2 (г) при 250С равна 0,1. В каком направлении будет идти реакция при следующих концентрациях веществ:
а) С(NO2) = С (N2O4) = 0,1 моль/л ?
б) С(NO2) = 0,01 моль/л; С (N2O4) = 0,02 моль/л?
Задача 7. Для реакции H2 + I2 ® 2HI при 4440С константа равновесия равна 50. Определите направление процесса, если исходная смесь имеет следующий состав: С(H2) = 2моль/л, С(HI) = 10моль/л.
Ответ:Состояние равновесия, т.к ∆G=0.
Задача 8 .Рассчитайте константу равновесия, если для данной реакции DG0 298 = - 4,478 кДж/моль.
Ответ: 6,1
Задача 9.Константа равновесия разложения лекарственного вещества в автоклаве при 413К равна 0,396∙105 Па, а при 443К - 1,286∙105 Па. Вычислить тепловой эффект реакции.
Ответ: 59,6 кДж/моль.
Задача 10.Используя значениеDG0, установите, существует ли угроза отравления при использовании в качестве наркотического средства оксида азота (I). Токсичный оксид азота (II) может образовываться по реакции 2N2O + O2↔4 NO. Все вещества находятся в газообразном состоянии. Для решения задачи используйте справочные данные.
Тестовые вопросы
1. Если энтальпия образования SO2 равна -297 кДж/моль, то количество теплоты, выделяемое при сгорании 16г серы, равно ____кДж.
1) 148,5 2) 297 3) 594 4)74,25
2. В реакции, протекающей в соответствии с термохимическим уравнением
3H2 + N2 = 2 NH3 + 92 кДж, выделилось 23 кДж теплоты. Объём полученного (при н.у.) аммиака равен____.
1) 5,6 л 2) 11,2л 3) 22,4л 4) 44,8л
3. По термохимическому уравнению реакции С2Н4 + Н2О ↔ С2Н5ОН +46 кДж
вычислите объём взятого этилена (н,у.), если известно, что выделившаяся в этом процессе теплота составила 138 кДж.
1) 44,8 л 2) 22,4л 3) 67,2 4) 89,6л
4. В реакцию, протекающую в соответствии с термохимическим уравнением
2Al + 3S = Al2S3 +509 кДж вступило 108 г алюминия. Количество выделившейся теплоты равно____.
1) 242,5 кДж 2) 509 кДж 3) 1018 кДж 4) 2036 кДж
5. В результате реакции, термохимическое уравнение которой 2Al +Fe2O3 = Al2O3 + 2 Fe +848 кДж, выделилось 169,6 кДж теплоты. Масса образовавшегося железа равна_____.
1) 11,2 г 2) 22,4 г 3) 56 г 4) 28 г
6. По термохимическому уравнению реакции горения ацетилена 2С2Н4 + 5О2 = 4СО2 + 2Н2О +2610 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило 67,2 л ацетилена (н.у.)
1) 870 кДж 2) 3915 кДж 3) 5220 кДж 4) 7830 кДж
7. В результате реакции, термохимическое уравнение которой 2С2Н4+ 5О2 = 4СО2 + 2Н2О +2610 кДж выделилось 652, 5 кДж теплоты. Объём сгоревшего ацетилена равен
1) 11,2 л 2) 22,4 л 3) 44,8 л 4) 67,2 л
8. Какое выражение соответствует константе химического равновесия для данной реакции
N2+3H2 = 2NH3
1) Kc = [NH3]2/ [N2]+[H2]3 3) Кр = [NH3]2 / [N2][H2]
2) Кс = [NH3]2 / [N2][H2]3 4) Кс = []N2][H2]3/ [NH3]2
9. Как нужно изменить давление, чтобы реакция гемоглобина с кислородом
Hb + O2 « HbO2 была смещена вправо?
1) уменьшить давление 2) увеличить давление 3) давление не влияет
10. Какое значение константы равновесия соответствует данной реакции 2NO +O2 « 2NO2
1) Kc= [NO2]2/ [NO][O2] 3) Kc= [NO][O2]/ [NO2]2
2) Kc= [NO2]2 / [NO]2[O2] 4) Kc= [NO2]/ [NO][O2]
11. Как нужно изменить давление реакции N2+3H2 « 2 NH3, чтобы сместить равновесие вправо?
1) уменьшить 3) не изменять
2) увеличить 4) увеличить давление NH3
12. Будет ли влиять давление на смещение равновесия данной реакции H2 + Cl2 = 2 HCl ?
1) будет 2) нет
3) сместит равновесие вправо 4) сместит равновесие влево
13. Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в обратном направлении?
1) DG0 < 0 2) DG0 > 0 3) DG0 = 0 4) DG0 = 1
14. Равновесие в реакции, уравнение которой СН4(г) + 4S(ж) ↔ СS2(г) + 2Н2S(г), ΔH<0, сместиться влево при ______.
1) понижении давления 3) дополнительном введении серы
2) понижении температуры 4) увеличении концентрации H2S
15. Будет ли протекать реакция в прямом направлении, если DG = 18 кДж/моль?
1) нет 2) химическое равновесие 3) будет
16. Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направлениях:
1) СO2(г) + C(т) ↔ 2СО(г), ΔН<0
2) J2(г) + 5 СО2(г) ↔ J2O5(т) + 5СО(г), ΔН>0
3) N2(г) + О2(г) ↔ 2 NO(г), ΔН>0
4) С2Н2(г) + 2Н2(г) ↔ С2Н6 (г), ΔН<0
17. Как нужно изменить давление, чтобы равнеовесие реакции гемоглобина с кислородом былаосмещено влево Hb + O2 « HbO2?
1) уменьшить давление 2) увеличить давление 3) давление не влияет
18. В реагирующей системе, уравнение которой NO(г) + Cl2(г) ↔ NOCl2(г) ΔH > 0, равновесие сместиться вправо при_____.
1) повышении давления 3) понижении температуры
2) использовании катализатора 4) повышении концентрации NOCl2
19. Для смещения равновесия в системе SO2(г)+Cl2(г) 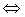 SO2Cl2(г), DH°<0 в сторону продуктов реакции необходимо_____,
SO2Cl2(г), DH°<0 в сторону продуктов реакции необходимо_____,
1) понизить температуру 3) понизить концентрацию SO2
2) понизить давление 4) ввести катализатор 5) повысить температуру
20. На состояние химического равновесия в системе 2SO2(г) + О2 (г) ↔2 SO3, ΔH0 < 0 не влияет____
1) катализатор 3) изменение температуры
2) изменение концентрации исходных веществ 4) изменение давления
21. Для нахождения 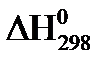 реакции
реакции 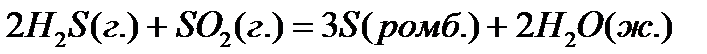 , следует воспользоваться формулой:
, следует воспользоваться формулой:
1) 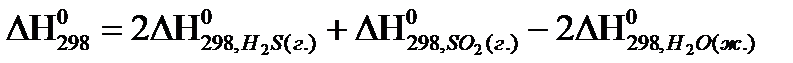
2) 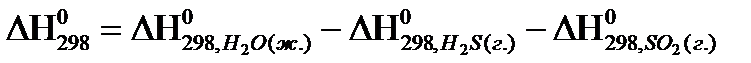
3) 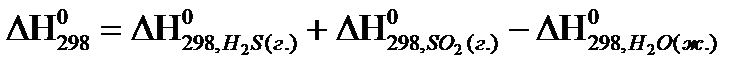
4) 
22. Для нахождения 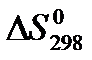 реакции
реакции 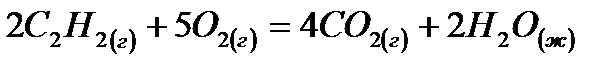 следует воспользоваться формулой: 1)
следует воспользоваться формулой: 1) 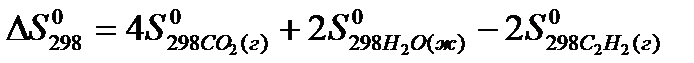
2) 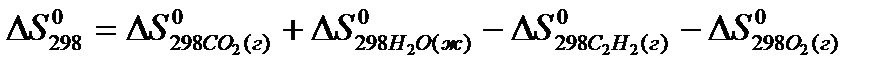
3) 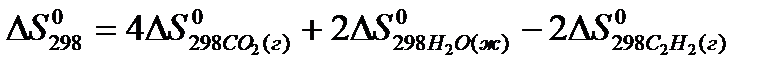
4) 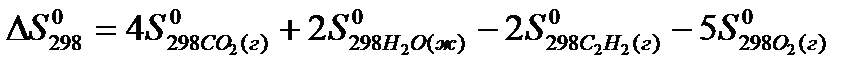
| <== предыдущая страница | | | следующая страница ==> |
| ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ | | | Определение осмотической концентрации и изотонического коэффициента раствора электролита» |
Дата добавления: 2014-09-10; просмотров: 1230; Нарушение авторских прав

Мы поможем в написании ваших работ!