
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Основы химической термодинамики
Раздел физической химии (происходит от греч. «терме» - теплота и «динамис» - сила). Изучает превращение теплоты, работы и других видов энергии, сопровождающих химические и физико – химические процессы. Наряду с учением о строении вещества, термодинамика является теоретической основой современной неорганической химии. Термодинамика – раздел химии, который решает 2 задачи:
1. Определение количества энергии, которое выделяется или поглощается при реакциях.
2. Возможность и направление самопроизвольного протекания химических реакций.
3. Переход энергии из одной формы в другую, от одной части системы к другой.
Термодинамическая система – это вещество или смесь веществ, ограниченных от окружающей среды. Различают 3 типа термодинамических систем:
1. Изолированные системы, которые не обмениваются ни веществом, ни энергией с окружающей средой. m = const, Eвнутр. = const.
2. Закрытые (замкнутые) системы, которые обмениваются энергией, но не обмениваются веществом. m = const, Евнутр.¹ const.
3. Открытые системы, которые обмениваются и веществом, и энергией. m ¹ const, Евнутр.¹ const.
В любом процессе соблюдается закон сохранения энергии, который выражается равенством:  , которое означает, что если к системе (веществу или совокупности веществ) подводится теплота Q, то в общем случае она расходуется на изменение внутренней энергии DU и на совершение работы А. Под внутренней энергией системы подразумевается общий ее запас (включая энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов в атомах, внутриядерную энергию и т.д., т.е. все виды энергии, кроме кинетической и потенциальной энергии системы в целом). Под величиной А имеют в виду работу против всех сил, действующих на систему (внешнее давление, электрическое поле, магнитное поле и т.д.).
, которое означает, что если к системе (веществу или совокупности веществ) подводится теплота Q, то в общем случае она расходуется на изменение внутренней энергии DU и на совершение работы А. Под внутренней энергией системы подразумевается общий ее запас (включая энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов в атомах, внутриядерную энергию и т.д., т.е. все виды энергии, кроме кинетической и потенциальной энергии системы в целом). Под величиной А имеют в виду работу против всех сил, действующих на систему (внешнее давление, электрическое поле, магнитное поле и т.д.).
Главные факторы, от которых зависит внутренняя энергия системы:
1. Состав
2. Количество вещества (чем больше вещества, тем больше энергия)
3. Условий, особенно от температуры.
4. Состояния системы, но не зависит от пути перехода в это состояние.
Например: 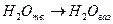
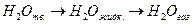 Если начальные условия системы (р1, Т1, V1) одинаковые и конечные условия системы (р2, Т2, V2) тоже одинаковые, то внутренние энергии конечного состояния системы одинаковы.
Если начальные условия системы (р1, Т1, V1) одинаковые и конечные условия системы (р2, Т2, V2) тоже одинаковые, то внутренние энергии конечного состояния системы одинаковы.
Предположим, что система за счет поглощения теплоты Q переходит из начального состояния 1 в конечное состояние 2, тогда:

Для химических реакций под работой против внешних сил подразумевается работа против внешнего давления. Обычно она совершается за счет расширения системы, например, при выделении газа в ходе реакции. Работа против внешнего давления равна произведению давления р на изменение объема системы DV при переходе ее из состояния 1 в состояние 2.
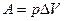 ;
; 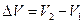 ;
; 
При изохорном процессе (V=const), поскольку изменения объема системы не происходит, то А=0. Тогда переходу системы из состояния 1 в состояние 2 отвечает равенство: QV=U2-U1=DV. Таким образом, если химическая реакция протекает при постоянном объеме, то выделение или поглощение теплоты QV связано с изменением внутренней энергии системы.
При изобарном процессе (р=const) тепловой эффект Qp равен:
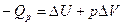 ;
; 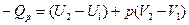 или
или 
Введем обозначение U+pV=H. Тогда Qp=H2-H1=DH. Величину Н называют энтальпией. Энтальпию можно рассматривать как энергию расширенной системы. Таким образом, если при изохорном процессе энергетический эффект реакции равен изменению внутренней энергии системы 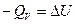 , то в случае изобарного процесса он равен изменению энтальпии системы
, то в случае изобарного процесса он равен изменению энтальпии системы 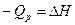 .
.
Т.к. нельзя вычислить абсолютную величину внутренней энергии, то нельзя вычислить и абсолютную величину энтальпии. Поэтому возможно только рассчитать DH и DU через тепловой эффект химической реакции.
Тепловой эффект химической реакции.
Тепловой эффект химической реакции – это количество тепла, которое выделяется или поглощается в результате протекания химической реакции. Измеряется в Дж или кДж.
Различают:
1. Экзотермические реакции (идут с выделением тепла), Q > 0
2. Эндотермические реакции (идут с поглощением тепла), Q < 0.
Изучением тепловых эффектов химических реакций занимается термохимия. Тепловой эффект химической реакции можно определить: экспериментально (с помощью калориметров) или рассчитать теоретически на основании законов термодинамики.
Тепловой эффект химической реакции определяется на основании закона Гесса (1841г.), который формулируется следующим образом: тепловой эффект химической реакции зависит только от вида (природы) и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий.
Пример: 


Закон Гесса справедлив для процессов, происходящих при постоянном объеме системы или при постоянном давлении. Предполагается также, что температура исходных веществ и продуктов реакции одинакова и что система не совершает никакой работы, кроме работы против внешнего давления, связанной с изменением объема при р = const.
Закон Гесса позволяет, зная тепловые эффекты реакции, рассчитать тепловые эффекты других реакций. Например: известны тепловые эффекты химических реакций:
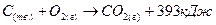 (1)
(1)
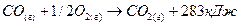 (2)
(2)
Нужно определить тепловые эффекты следующей реакции:
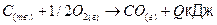 (3)
(3)
Решение с помощью энергетических диаграмм:
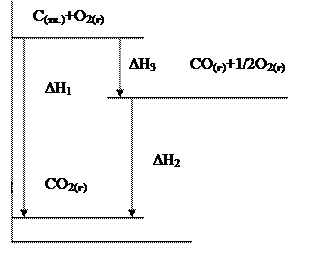
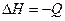
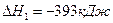
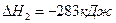
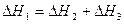
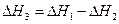
DН3=-110кДж
Уравнения с указанием теплового эффекта называют термохимическими уравнениями. Их особенности:
1. Обязательно указывается агрегатное состояние вещества;
2. Тепловой эффект относится к тому количеству вещества, которое указывается в данном уравнении;
3. Можно ставить дробные коэффициенты;
4. С термохимическими уравнениями можно производить те же действия, что и с алгебраическими уравнениями.
Для решения нашей задачи можно произвести следующие действия:
Из (1) уравнения вычесть (2) уравнение, чтобы получить (3) уравнение:
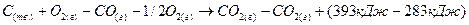
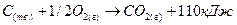
Из закона Гесса вытекает ряд выводов, из которых наиболее важны:
1. Тепловой эффект любой химической реакции равен разности между суммой теплот образования продуктов реакции и суммы теплот образования исходных веществ с учетом их стехиометрических коэффициентов;
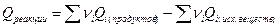 , где
, где 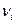 -стехиометрические коэффициенты при данных веществах.
-стехиометрические коэффициенты при данных веществах.
И аналогично: 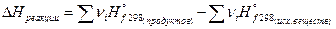
2. Теплота образования химического соединения равна её теплоте разложения с противоположным знаком. 
Итак, в термохимических расчетах широко используют энтальпии (теплоты) образования веществ. Под теплотой образования химического соединения подразумевают тепловой эффект химической реакции образования 1 моль вещества из простых веществ (устойчивых при стандартных условиях - 25°С, 101.3 кПа). Измеряется в кДж/моль. Теплоты образования простых веществ равны 0.
Тепловые эффекты некоторых процессов
В некоторых случаях знак теплового эффекта можно предсказать заранее.
1. Реакция образования или разрыва химической связи 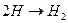 Q>0
Q>0
2. Фазовые переходы: твёрдое тело®жидкость®газ
Q<0 Q<0
3. Из менее полярных связей образуются более полярные 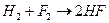 Q>0
Q>0
| <== предыдущая страница | | | следующая страница ==> |
| Сложение и вычитание векторов | | | Направленность физико – химических процессов |
Дата добавления: 2014-09-26; просмотров: 260; Нарушение авторских прав

Мы поможем в написании ваших работ!