
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Тема. Электрохимические процессы
Теоретические вопросы по теме «Основы электрохимии».
- Понятие об окислительно – восстановительных реакциях.
- Электрохимические процессы. Понятие об электроде.
- Механизм возникновения двойного электрического слоя.
- Электродный потенциал. Уравнение Нернста.
- Водородный электрод.
- Токовые и бестоковые реакции.
- Процессы, протекающие на катоде и аноде при работе гальванического элемента.
- Электролиз. Закон Фарадея.
Теоретическая часть.
Электрохимия - это раздел химии, который изучает процессы, протекающие на границе раздела двух фаз, например металл-раствор, с участием заряженных частиц (ионов и электронов).
Окислительно – восстановительные реакции - это реакции, протекающие с изменением степеней элементов и сопровождающиеся передачей электронов.
Степень окисления элемента (СО)- это условный заряд элемента, согласно его электроотрицательности.
Окисление (о-е) – процесс повышения степени окисления элемента.
Восстановитель (в-е) - процесс понижения степени окисления элемента.
Окислитель (о-ль) – элемент, который понижает свою степень окисления (принимает электроны).
Восстановитель (в-ль) - элемент, который повышает свою степень окисления (отдаёт электроны).
Алгоритм уравнивания окислительно-восстановительных реакций
Схема окислительно-восстановительных реакций.
KMnO4 + Na2SO3 + H2SO4 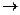 MnSO4 + H2O + K2SO4 + Na2SO4
MnSO4 + H2O + K2SO4 + Na2SO4
1. Проставить степени окисления (СО) у всех элементов участвующих в реакции.
2. Определить пары элементов, изменяющих СО.
3. Записать уравнение ОВР в ионном виде.
K+ + MnO4- + 2Na+ + SO32- + 2H+ + SO42- 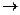 Mn2+ + SO42- + H2O + 2K+ + 2Na+ + SO42-
Mn2+ + SO42- + H2O + 2K+ + 2Na+ + SO42-
рН<7
4. Подчеркнуть ионы, в состав которых входят элементы, изменяющие СО.
2KMn+7O4 + 5Na2S+4O3 + 3H2SO4 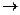 2Mn+2SO4 + 3H2O + K2SO4 + 5Na2S+6O4
2Mn+2SO4 + 3H2O + K2SO4 + 5Na2S+6O4
5. Записать уравнение ОВР в ионном виде.
K+ + MnO4- + 2Na+ + SO32- + 2H+ + SO42- 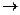 Mn2+ + SO42- + H2O + 2K+ + 2Na+ + SO42-
Mn2+ + SO42- + H2O + 2K+ + 2Na+ + SO42-
рН<7
6. Определить рН среды. (Наличие ионов H+ - показатель кислой среды, рН<7; наличие ионов ОH- - показатель щелочной среды, рН>7; НОН – нейтральная среда рН=7)
7. Записать полуреакции окисления и восстановления:
а) уравнять число элементов в правой и левой частях полуреакций ( в кислой среде используют для уравнивания атомов водорода H – ионы Н+, а для уравнивания атомов кислорода O –молекулы Н2О; в щелочной и нейтральной средах для уравнивания атомов водорода H используют Н2О; а для уравнивания атомов кислорода O – гидроксид –ион ОН-, причем, на каждый недостающий атом О добавляют 2ОН-);
б) над каждой частью полуреакции записать «степень окисления»;
в) определить и записать процесс (о-е или в-е) и восстановитель или окислитель;
г) привести полуреакцию к электронному балансу.
То же (а-г) проделать со второй полуреакцией
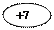 | 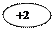 |
MnO4- + 8H+ + 5e  Mn2+ + 4HOH, в-е
Mn2+ + 4HOH, в-е

 о-ль
о-ль
SO32- + HOH – 2e  SO42- + 2H+, ок-е
SO42- + 2H+, ок-е
 в-ль
в-ль


8. Найти наименьшее общее краткое числа электронов (n) и соответствующие коэффициенты для каждой полуреакции.
n

 MnO4- + 8H+ + 5e
MnO4- + 8H+ + 5e 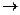 Mn2+ + 4 HOH, в-е 2
Mn2+ + 4 HOH, в-е 2
о-ль
SO32- + HOH – 2e 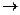 SO42- + 2H+, ок-е 5
SO42- + 2H+, ок-е 5
в-ль
 |
9. Сложить правые и левые части полуреакций, умножая на коэффициенты.
10. В полученном уравнении привести подобные члены. Получить сокращенное полное уравнение ОВР.
 MnO4- + 8H+ + 5e
MnO4- + 8H+ + 5e 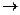 Mn2+ + 4 HOH, в-е 2
Mn2+ + 4 HOH, в-е 2
о-ль
SO32- + HOH – 2e 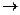 SO42- + 2H+, ок-е 5
SO42- + 2H+, ок-е 5
 в-ль
в-ль


 6 3
6 3
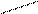
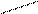
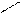 2MnO4- + 16H+ + 5SO32- + 5 HOH
2MnO4- + 16H+ + 5SO32- + 5 HOH 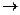 2Mn2+ + 8 HOH + 5SO42- + 10H+
2Mn2+ + 8 HOH + 5SO42- + 10H+
11. Из этого уравнения перенести коэффициенты в уравнение в молекулярной форме
2KMnO4 + 5Na2SO3 + 3H2SO4 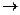 2MnSO4 + 3 HOH + K2SO4 + 5Na2SO4
2MnSO4 + 3 HOH + K2SO4 + 5Na2SO4
12. Проверить равенство количества элементов в правой и левой частях уравнения.
| <== предыдущая страница | | | следующая страница ==> |
| дефекты сварных швов. Внешние дефекты и их характеристики | | | Теория гальванических элементов |
Дата добавления: 2014-09-29; просмотров: 2049; Нарушение авторских прав

Мы поможем в написании ваших работ!