
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
УГЛЕВОДЫ
|
Читайте также: |
Углево́ды (сахара) – органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. Эти вещества состоят из углерода, водорода и кислорода, причём соотношение числа атомов водорода и кислорода для большинства углеводов, такое же, как в воде. Отсюда и произошло их название, которое было предложено
К. Шмидтом 1844 году. Общая формула углеводов Сn(H2O)m.
Соединения этого класса составляют около 80 % сухой массы растений и 2…3 % массы животных.
Углеводы делятся на две группы:
1) моносахариды или монозы;
2) полисахариды или полиозы.
Полисахариды в свою очередь подразделяются на сахароподобные или олигосахариды (это низкомолекулярные полисахариды) и несахароподобные (высокомолекулярные полисахариды).
Молекулы полисахаридов построены из остатков моносахаридов и при гидролизе расщепляются на более простые углеводы. Монозы гидролитическому расщеплению не подвергаются.
12.1 Моносахариды
В природе встречаются в основном два вида моносахаридов: пентозы С5Н10О5 и гексозы С6Н12О6. И те и другие могут вести себя или как гидроксиальдегиды – это альдозы, или как гидроксикетоны – это кетозы.
Среди пентоз и гексоз наиболее распространены два моносахарида: глюкоза и фруктоза (плодовый сахар). Оба соединения – гексозы. Глюкоза – это альдоза, фруктоза – кетоза.
Строение глюкозы и фруктозы может быть подтверждено различными реакциями:
– При восстановлении с HI оба соединения дают 2-йодгексан

Эта реакция показывает, что глюкоза и фруктоза имеют нормальную (без разветвлений) цепочку из шести углеродов.
– Глюкоза при окислении в мягких условиях даёт глюконовую кислоту, что указывает на присутствие альдегидной группы.

Окисление фруктозы идёт трудно с разрывом углеродной цепи, что указывает на кетонную группу.
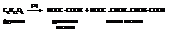
– Глюкоза и фруктоза реагируют с уксусным ангидридом. Причём один моль углевода взаимодействует с пятью молями ангидрида с образованием сложного эфира.

Следовательно, обе гексозы имеют по пять гидроксилов.
Из этих реакций следует, что глюкоза имеет формулу альдегидоспирта, и называется альдозой
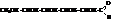
а фруктоза – кетоспирта и называется кетозой.
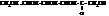
Однако известен ряд фактов, которые не могут удовлетворительно объясняться этими формулами. Например, глюкоза и фруктоза не вступают в реакцию с бисульфитом натрия (NaHSO3), характерной для карбонильной группы. В реакции глюкозы с активным алкилирующим средством иодистым метилом CH3I образуется пентаметилглюкозид. В реакции с мягким алкилирующим средством, метанолом – реагирует только один гидроксил. Весьма интересно, что образующееся при этом производное глюкозы (метилглюкозид) лишено альдегидных свойств. Этот особый гидроксил, с которым идет взаимодействие, в глюкозе называется глюкозидным (полуацетальным) гидроксилом, а в случае других углеводов – гликозидным.
Таутомерия моносахаридов
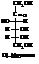
Указанные выше явления, а также многие другие, хорошо объясняются циклическими формулами глюкозы и фруктозы, которые образуются в результате таутомерных превращений моносахаридов
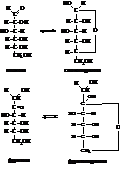
На показанной выше схеме при образовании циклической полуацетальной формы глюкозы к кислороду карбонильной группы присоединяется атом водорода от гидроксила при пятом углероде (Полуацетали образуются в реакциях карбонильных соединений со спиртами. См. тему «Карбонильные соединения»). Образуется глюкозидный (в других углеводах – гликозидный) гидроксил, а свободные валентности первого углерода и кислорода при пятом углероде взаимно насыщаются, образуя циклическую структуру. Аналогичная по типу перестройка происходит в молекуле фруктозы. Здесь кольцо образуется за счёт гидроксила у шестого и карбонила второго углеродов. Фруктоза может образовывать и пятичленный цикл (за счет гидроксила при пятом углероде), правда, менее устойчивый по сравнению с шестичленным.
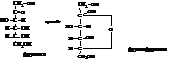
В растворах глюкозы и фруктозы (и всех других моносахаридов) между открытыми и циклическими формами устанавливается таутомерное равновесие, сильно сдвинутое в сторону последних. Циклические полуацетальные формы предпочтительнее энергетически. Альдегидные и кетонные группы в них отсутствуют. В химическом отношении они ведут себя как многоатомные спирты, которые в соответствующих условиях могут переходить в гидроксикарбонильную открытую форму. Открытые формы за счет альдегидных или кетонных групп проявляют восстанавливающие свойства. Например, альдозы вступают в реакции с реактивом Фелинга, «серебряного зеркала» и др.
Гликозидный гидроксил из-за значительного влияния кислорода кольца по активности превосходит спиртовые гидроксильные группы при других углеродах. Поэтому метанол в первую очередь реагирует с этим гидроксилом. Полученный циклический метилглюкозид лишён альдегидных (восстанавли-вающих) свойств, так как таутомерное превращение с образованием открытой формы в этом случае невозможно (алкильная группа не может мигрировать к циклическому кислороду).
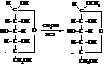
Сравнение циклических форм глюкозы и фруктозы с формулами гетероциклических соединений пирана и фурана показывает, что в них содержатся гидрированные кольца этих соединений.
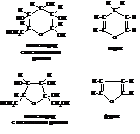
Поэтому при обозначении размеров окисных колец моносахариды с пятичленными циклами называют фуранозами, а с шести-членными – пиранозами.
Стереохимия моносахаридов
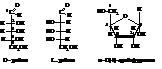
Формула глюкозы в альдозной форме показывает, что в её молекуле имеется четыре асимметрических атома углерода
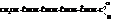
Следовательно, для неё возможны 24=16 оптических стерео-изомеров: восемь D-ряда и восемь – L ряда. Из формулы также видно, что стереоизомеры могут различаться между собой только взаимным расположением в пространстве водородных атомов и гидроксильных групп. Отнесение моноз к D- или L-ряду как известно не связано со знаком вращения и определяется генетической связью с D- или
L-глицериновым альдегидом.
Из глицеринового альдегида можно получить глюкозу, например, оксинитрильным синтезом (см. ниже в химических свойствах моносахаридов). При этом группа атомов глицеринового альдегида, определяющая конфигурацию, не изменяя конфигурации переходит из альдегида в глюкозу.
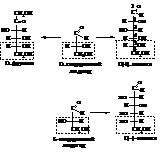
Таким образом, отнесение моносахарида к D- или L-ряду определяется строением только одного, предпоследнего тетраэдра. Строение других тетраэдров моносахарида может определять знак и угол вращения плоскости поляризации поляризованного света, но не отнесение к D- или L-стереохимическим рядам.
Монозы, отличающиеся строением только одного, обычно второго, тетраэдра, называются эпимерами. Например, эпимерами являются D(+)-глюкоза и D(+)-манноза.
В глюкопиранозе, то есть в циклической полуацетальной форме глюкозы, содержится пять асимметрических атомов углерода. Поэтому она может существовать в виде 25=32 оптических изомеров:
8 стереоизомеров D-ряда, 8 – L-ряда и кроме того каждый из них может иметь α- и β-формы, которые называют аномерами. Они отличаются друг от друга положением водорода и гидроксила в тетраэдре с глюкозидным гидроксилом.
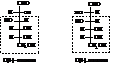
До сих пор для изображения пространственного расположения отдельных групп в молекулах моносахаридов использовались проекционные формулы Фишера. Однако существуют и другие способы отображения пространственного строения углеводов.
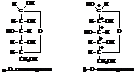
Примером могут служить перспективные формулы Хеуорса для циклических форм углеводов, которые несколько ближе к истинной геометрической форме молекул моносахаридов, хотя и не вполне соответствуют им. При переходе от проекционных формул к перспективным атомы и группы, расположенные в формулах Фишера слева, пишутся над кольцом, а расположенные справа – под кольцом. Плоскость кольца перпендикулярна плоскости чертежа.
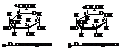
Расположение атома водорода и группы – СН2ОН у пятого углерода является исключением. Водород, казалось бы, должен располагаться наверху, а группа –СН2ОН – внизу. Однако для образования кислородного мостика с замыканием цикла в реальной молекуле необходим поворот группы атомов вокруг связи атомов С4–С5. При этом гидроксил занимает удобное положение для образование кольца. Соответственно, синхронно поворачиваются группа –СН2ОН и водород.
Формулы Хеуорса широко используются для изображения строения углеводов. Всё же они не вполне адекватно отражают пространственное расположение атомов хотя бы потому, что плоское шестичленное кольцо является напряжённым и не может существовать в реальных условиях.
Работами, прежде всего, Ривса показано, что пиранозы существуют, подобно циклогексану, в конформациях «кресло» и «ванна», причём первые энергетически выгоднее. В отличие от циклогексана, представленного двумя крайними конформациями, вследствие наличия в кольце кислорода и асимметрических атомов углерода пиранозы имеют 8 таких конформаций: 2 – «кресла» и 6 – «ванн».
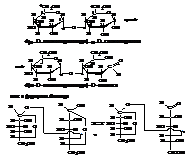
Одна из устойчивых конформаций кресла α-D-глюкопиранозы имеет вид:
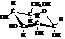
О номенклатуре моносахаридов
Обычно для названий моносахаридов используется тривиальная номенклатура (например: глюкоза, фруктоза, манноза и т.д.). Изменение пространственного строения хотя бы одного тетраэдра (но не всех) в открытых формах (и соответственно, в циклических) влечет за собой изменение названия корневого моносахарида (например, эпимеры глюкоза и манноза). Обязательно указание в названии на принадлежность углевода к D- или L-стереохимическим рядам.
В названиях циклических форм моносахаридов должны приводится сведения о названии корневого углевода, типе аномера
(α- или β-), принадлежности к D- или L- рядам, размере цикла (смотри названия в приведенной выше схеме). Тип аномера (α- или β-) определяется сравнением строения тетраэдра с гликозидным гидроксилом со строением тетраэдра, определяющего конфигурацию соединения (предпоследний от карбонильной группы). При одинаковом их строении – это α-аномер, при разном – β-аномер.
Если замещение водорода на какую-либо группу или атом произошло в гликозидном гидроксиле, в названии этого производного должно быть окончание –зид (например: метил-α-D-глюкопиранозид); при замещении в спиртовых гидроксилах указываются номера углеродов, при которых находятся эти гидроксилы (например:
2,3-диметил-α-D-глюкопираноза; 1,2,3-триацетил- β-D-фруктофуранозид).
Мутаротация
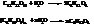
В твёрдом состоянии все 32 циклических стереоизомера глюкозы устойчивы. Стоит любой из них растворить, например, в воде, как начинаются их взаимные переходы. Если, к примеру, приготовить раствор обычной природной D-глюкозы (это α–D-глюкопираноза), то будет наблюдаться очень интересное явление: удельное вращение раствора [α]D = +110° постепенно с течением времени будет умень-шаться, пока не достигнет постоянной величины [α]D= +52°. Это явление самопроизвольного изменения величины угла оптического вращения свежеприготовленных растворов моносахаридов называется мутаротацией. Оно обусловлено тем, что в растворе аномеры переходят друг в друга, причём между ними со временем устанавливается подвижное равновесие. Переходным состоянием при этом является карбонильная форма глюкозы.
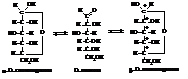
Поскольку аномеры, являясь как оптические изомеры, диастереоизомерами, вращают плоскость поляризации на разные углы, то с изменением концентраций α- и β- форм меняется и угол вращения раствора. Так, [α]D α–D-глюкопиранозы = 110°, [α]D β–D-глюкопиранозы 19°, в равновесии, когда соотношение аномеров становится неизменным, раствор имеет величину удельного вращения [α]D = 52°. При этом равновесное содержание α- и β-форм глюкозы в растворе 39,4 и 60,2 % соответственно. Строго говоря, при растворении природной α–D-глюкопиранозы, также как и других способных к мутаротации углеводов и их производных, кроме промежуточной карбонильной формы и другого аномера образуются еще гидратированная альдегидная форма глюкозы и пара аномеров с фуранозным циклом. Однако после установления равновесия, в растворе преобладают более термодинамически устойчивые пиранозные формы (их суммарное содержание ~ 99,5 %). Промежуточная карбонильная форма, фуранозы, а также гидратированная форма присутствуют в растворе в следовых количествах.
Мутаротировать в растворах могут и другие моносахариды, а также их производные, дисахариды и в общем случае олигосахариды при условии наличия в их молекулах свободного гликозидного (полуацетального) гидроксила. В этом случае углевод или его производное способно к таутомерии с образованием промежуточной карбонильной формы и переходу в другой аномер. Естественно, как исходный, так и равновесный углы удельного вращения раствора будут индивидуальны для каждой мутаротирующей системы и отличаться от наблюдаемых для глюкозы.
Физические свойства моносахаридов
Углеводы – это кристаллические вещества. Моносахариды и многие олигосахариды хорошо растворимы в воде. Сладкие на вкус. Например, если принять сладость свекловичного сахара (сахароза) за 100, то относительная сладость глюкозы – 74, фруктозы – 173.
Получают их чаще всего из ди- и полисахаридов гидролизом в присутствии кислот или энзимов:
а также специальными химическими методами, описанными ниже.
Химические свойства моносахаридов
В химическом отношении монозы в растворах проявляют свойства спиртов, карбонильных соединений и полуацеталей. В каждой конкретной реакции моносахарид реагирует либо в открытой, либо в циклической форме.
– Алкилирование в мягких условиях даёт алкилглюкозид. Причём в реакцию вступает только наиболее активный гликозидный (полуацетальный) гидроксил. В жёстких условиях реакция идёт глубже. Моносахариды вступают в процесс в циклической форме.
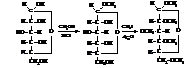
α-D-глюкопираноза метил-α-D-глюкопиранозид
пентаметил-α-D-глюкопиранозид
– Аналогично протекает реакция ацилирования
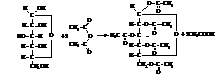 α-D-глюкопираноза пентаацетил-α-D-глюкопиранозид
α-D-глюкопираноза пентаацетил-α-D-глюкопиранозид
– Альдозы легко окисляются. В мягких условиях образуются одноосновные гидроксикислоты (альдоновые кислоты). При энергичном окислении получаются двухосновные гидроксикислоты

– При восстановлении моносахариды переходят в многоатомные спирты
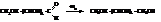
– Реакции моносахаридов с синильной кислотой позволяют устанавливать конфигурацию молекулы и из низших моносахаридов получать высшие.
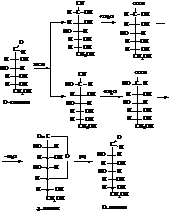
При действии на D-глюкозу HCN образуются два эпимерных оксинитрила. Гидролиз их даёт соответствующие кислоты, в которых уже на один атом углерода больше, чем в исходном соединении. Внутримолекулярная дегидратация кислот приводит к лактонам, восстановление которых дает две эпимерные гептозы. Вся последовательность этих реакций называется оксинитрильным синтезом.
– Реакция с гидроксиламином – метод установления структуры углеводов и перехода от высших моноз к низшим. Превращение протекает по схеме: образование оксима, его дегидратация до оксинитрила, отщепление HCN в присутствии влажного оксида серебра.
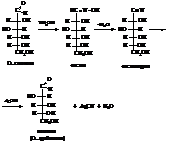
Деградация альдоз по Руффу представляет собой декарбокислирование соли альдоновой кислоты, в результате которого углеродная цепь альдозы укорачивается на один атом со стороны альдегидной группы. Окисление альдозы до альдоновой кислоты происходит под действием бромной воды. Декарбоксилирование проводят смесью пероксида водорода и соли трехвалентного железа:
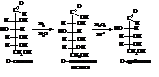
– Реакция с фенилгидразином является методом перехода от альдоз к кетозам.
– При действии щелочей моносахариды, подвергаясь тауто-мерии, дают промежуточную енольную форму и могут менять строение второго тетраэдра углевода, переходя в эпимерное соединение.
– Брожение гексоз – сложный процесс расщепления моносахаридов под влиянием микроорганизмов. Сопровождается обычно образованием газообразных продуктов, спиртов, кислот и т.д.
Спиртовое брожение:

Маслянокислое брожение:
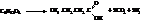
Молочнокислое брожение:
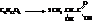
Лимоннокислое брожение:
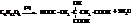
и другие виды брожения.
Таким образом, реакции моносахаридов с синильной кислотой, гидроксиламином, фенилгидразином, деградации по Руффу и в щелочных растворах указывают на генетическую связь различных моносахаридов. Они позволяют осуществлять взаимный переход от одних моносахаридов к другим, отличающихся составом, строением и конфигурацией. При помощи этих, а также некоторых других реакций, было получено много индивидуальных сахаров и изучены их свойства.
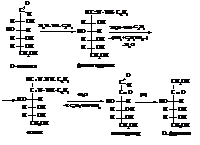
Альдопентозы
Альдопентозы имеют следующее строение.
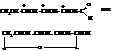
Согласно первой формуле в молекуле находятся три асимметрических атома углерода и возможны 8 стереоизомеров а согласно второй, для каждого из 8 – ещё α- и β-формы.
Арабиноза
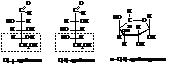
В природе встречается L(+)-арабиноза.
Ксилоза
В природе встречается D(+)-ксилоза.
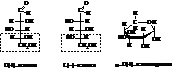
Рибоза
Рибоза играет большую биологическую роль. Она входит в состав рибонуклеиновых кислот (РНК). Остаток ее производного, дезоксирибоза, в котором гидроксильная группа у второго атома углерода замещена водородом с потерей атома кислорода (дезокси – отсутствие атома кислорода), входит в состав дезоксирибонукле-иновых кислот (ДНК).
В природе пентозы встречаются, главным образом, в виде полисахаридов – пентозанов – которые при гидролизе дают пентозы
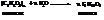
Пентозаны обнаружены в древесине, в сене, соломе, подсолнечной лузге и т.д.
При нагревании с кислотами пентозы отщепляют по 3 молекулы воды и переходят в циклический альдегид – фурфурол.
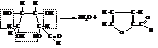
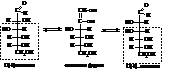
Гексозы
Из гексоз наибольшее значение имеют D-глюкоза, D-манноза,
D-галактоза и D-фруктоза.
D-(+)-глюкоза или виноградный сахар в больших количествах содержится в растениях и живых организмах.
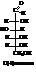
Очень много её в соке винограда и других сладких плодов. Распространённости глюкозы способствует большая устойчивость её конформации. D-(+)-глюкоза – сладкое вещество (примерно 2/3 сладости тростникового сахара), кристаллическое.
При восстановлении глюкоза даёт 6-атомный спирт – сорбит. Он тоже сладок и находится в ягодах рябины, соке вишен, слив, яблок, груш и т.д.
В промышленности глюкозу обычно получают из крахмала кипячением его с разбавленной серной кислотой. Глюкоза применяется в кондитерском производстве как дешёвый заменитель тростникового сахара. В хлопчатобумажной промышленности она используется как восстановитель при крашении и печатании. Из глюкозы получают аскорбиновую кислоту (витамин «С»).
D-(+)-манноза сравнительно мало распространена в природе и встречается в ячмене, пшенице и т.д.
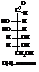
При восстановлении даёт спирт – маннит, который встречается в высушенном соке некоторых южных растений (маслины, жасмин, ясень…). И манноза и маннит сладкие на вкус.
D-(+)-галактоза встречается в природе в виде полисахаридов, (молочный сахар).
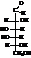
D-(+)-галактоза
При восстановлении даёт спирт, дульцит, содержащийся в растениях.
D-(–)-фруктоза или фруктовый сахар вместе с глюкозой находится в соке многих плодов.
Смесь равных количеств D-глюкозы и D-фруктозы составляет около 80 % массы мёда. Фруктоза в 1,5 раза слаще тростникового сахара и 2 раза слаще глюкозы.
12.2 Дисахариды
Дисахариды при гидролизе дают два одинаковых или разных моносахарида. Строение и свойства дисахаридов зависят от того, в каких формах присутствуют в них моносахариды: α- или β-, пиранозной или фуранозной, за счет каких гидроксилов связаны между собой остатки моносахаридов в молекуле дисахарида.
Дисахариды делятся на две группы: восстанавливающие и невосстанавливающие дисахариды.
К восстанавливающим дисахаридам относятся мальтоза, целлобиоза, лактоза.
Мальтоза или солодовый сахар при гидролизе расщепляется на две молекулы D-глюкозы. Поскольку на образование эфирной связи между остатками молекул моносахаридов используется только глюкозидный гидроксил первого остатка, а глюкозидный гидроксил второго остатка остается свободным, мальтоза способна к таутомерии с раскрытием цикла второго остатка.
Присутствие открытой формы с альдегидной группой делает мальтозу хорошим восстановителем. Подобно моносахаридам она вступает во все реакции карбонильной группы, спиртовых и полуацетального гидроксилов. Она мутаротирует в водных растворах.
Мальтоза получается при неполном гидролизе крахмала.
Целлобиоза также является восстанавливающим дисахаридом. От мальтозы она отличается тем, что первым остатком ней является остаток β-D-глюкопиранозы , а не α-D-глюкопиранозы как в мальтозе.
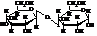
4(β-D-глюкопиранозидо)–α-D-глюкопираноза Карбонильная форма: 4(β-D-глюкопиранозидо)–D–глюкоза
Целлобиоза получается при неполном гидролизе целлюлозы.
Лактоза или молочный сахар состоит из остатков β-D-галактозы в пиранозной форме и D-глюкозы. Молочный сахар содержится в молоке (в коровьем 4…5 %). Менее сладок, чем тростниковый сахар.
К группе невосстанавливающих дисахаридов относятся сахароза и трегалоза. К таутомерии они неспособны, так как эфирная связь между остатками образована с участием обоих гликозидных гидроксилов.
Сахароза – тростниковый или свекловичный или просто сахар. При гидролизе даёт глюкозу и фруктозу и состоит из остатков
α-D-глюкозы в пиранозной и β-D-фруктозы в фуранозной формах:
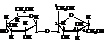
2-(α-D-глюкопиранозидо)- β -D-фруктофуранозид
или в формулах Фишера
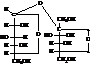
Сахароза широко распространена в природе. Например, в сахарной свекле её содержание доходит до 28 % от веса сухого вещества. Получают сахарозу из сахарной свеклы и сахарного тростника.
Является весьма важным питательным и вкусовым веществом. Хорошо усваивается организмом человека. При сгорании 1 г сахарозы выделяется 16,7 кДж·моль-1 энергии.
Сахароза образует бесцветные прозрачные кристаллы (tпл=160 °С). Расплавленная сахароза застывает в аморфную массу, называемую карамелью.
Инверсия сахарозы
Раствор сахарозы вращает плоскость поляризации вправо. При гидролизе она расщепляется на эквимолекулярные количества
D-(+)-глюкозы и D-(–)-фруктозы.
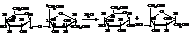
При этом фруктоза значительно сильнее вращает влево, чем образующаяся глюкоза и еще остающаяся в растворе сахароза – вправо. Поэтому, по мере течения реакции гидролиза образующаяся фруктоза постепенно компенсирует слабое правое вращение еще остающейся в растворе сахарозы и получающейся глюкозы. Поэтому правое вращение раствора со временем уменьшается, а затем происходит перемена направления вращения плоскости поляризации. Это явление называется инверсией сахарозы. Получающаяся в результате гидролиза смесь равных количеств глюкозы и фруктозы называется инвертным сахаром (инвертным сиропом) и используется в кондитерской промышленности, а также в качестве добавок к натуральному меду.
Трегалоза [1-(α-D-глюкопиранозидо)-β-D-глюкопиранозид] состоит из остатков двух молекул α-D-глюкопиранозы, соединённых за счёт глюкозидных гидроксилов.
12.3 Полисахариды
Полисахари́ды – общее название класса сложных высокомолеку-лярных углеводов, молекулы которых состоят из десятков, сотен или даже тысяч остатков моносахаридов.
К этой группе сахаров относятся крахмал и целлюлоза (клетчатка). Оба полисахарида построены из остатков глюкозы: крахмал – из остатков α-D-глюкопиранозы, клетчатка – β-D-глюкопиранозы.
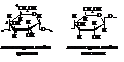
Их общая формула (С6H10O5)n или [ C6H7O2(OH)3]n
Крахмал
Крахмал содержится в растениях и является запасным питательным веществом для них. Для человека и животных он также служит важнейшим питательным веществом. Крахмал в виде зёрен откладывается преимущественно в клубнях и зёрнах растений. Например, в основном техническом источнике крахмала – клубнях картофеля – содержится ~ 20 % крахмала. В зёрнах пшеницы его до 70 %.
Крахмал – представляет собой белый нерастворимый в воде порошок. С йодом крахмал даёт синее окрашивание, которое исчезает при нагревании и вновь появляется при охлаждении. Зерно крахмала построено из двух различных веществ: амилозы, которая составляет внутреннюю часть зерна и амилопектина, являющегося оболочкой.
Амилоза построена из нескольких сот остатков α-D-глюкозы, соединённых по 1,4-связям и образующих линейную цепочку. В амилопектине линейные цепи связаны между собой ещё 1,6-связями и образуют высокоразветвлённые молекулы.
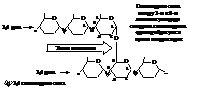 Содержание амилозы в крахмале составляет 10…30 %, амилопектина – 70…90 %. Амилопектин с водой даёт клейстер, амилоза – коллоидный раствор.
Содержание амилозы в крахмале составляет 10…30 %, амилопектина – 70…90 %. Амилопектин с водой даёт клейстер, амилоза – коллоидный раствор.
При гидролизе крахмал постепенно расщепляется на более простые углеводы по схеме: крахмал → растворимый крахмал → декстрины → мальтоза → D-глюкоза.
Крахмал имеет большую пищевую ценность. Из него изготовляют клей, гидролизом получают глюкозу.
Декстрины используются в ситцепечатании, для загустки красок. Блестящая корочка хлеба также состоит из декстринов. Основное значение хлебопечения состоит в превращении нерастворимого крахмала в растворимые и легко усваиваемые организмом декстрины.
Очень близок по строению к крахмалу гликоген или животный крахмал. Это разветвленный полисахарид (C6H10O5)n со связями 1…4 в линейных участках и 1…6 в разветвлениях (аналогично амилопектину крахмала), молекулы которого также построены из остатков
α-D-глюкопиранозы. Основной запасной углевод человека и животных. Гликоген является основной формой хранения глюкозы в животных клетках. Гликоген содержится во всех тканях, откладывается в печени и является резервным веществом в организме человека и животных (в растениях такие функции выполняет крахмал). Гликоген образует энергетический резерв, который может быть быстро мобилизован при необходимости восполнить внезапный недостаток глюкозы, недостаток энергии.
Целлюлоза (клетчатка)
По общей своей массе целлюлоза на Земле занимает первое место среди всех органических соединений. Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенку растительных клеток. В большом количестве целлюлоза содержится в тканях древесины (40…55 %), в волокнах льна (60…85 %) и хлопка (95…98 %). Основная составная часть оболочки растительных клеток (отсюда второе название – клетчатка). Образуется в растениях в процессе фотосинтеза.
Молекулы целлюлозы, подобно молекулам амилозы крахмала, имеют линейное строение (степень полимеризации 6…12 тысяч остатков). Целлюлоза не растворяется в воде, эфире и спирте, устойчива к действию разбавленных щелочей, кислот, слабых окислителей. Растворима в реактиве Швейцера (раствор комплексного соединения Cu(NH3)n(OH)2 в концентрированной серной кислоте).
При действии на целлюлозу растворов кислот, она гидролизуется до D-глюкозы.
В промышленных масштабах целлюлозу выделяют в огромных количествах при производстве бумаги. Значительное количество целлюлозы идёт на получение искусственных волокон, пластмасс, порохов.
Важное практическое значение имеют простые и сложные эфиры целлюлозы с органическими и неорганическими кислотами. На каждую элементарную ячейку молекулы клетчатки приходится по три гидроксила, которые и могут вступать в реакцию. Полностью нитрованная клетчатка является взрывчатым веществом – пироксилином, из которого приготовляют бездымный порох.
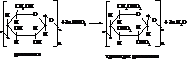
Менее глубоко нитрованная клетчатка называется коллоксилином. Раствор его в спирте и эфире под названием коллодий применяется в медицине. Коллоксилин идёт на получение нитролаков и эмалей, которые в значительных количествах расходуются на окраску автомобилей. Смесь коллоксилина и камфоры (1:3) называется целлулоидом, из которого изготовляют киноплёнку (горючую), игрушки и другие изделия.
При взаимодействии целлюлозы с уксусным ангидридом в присутствии уксусной и серной кислот образуется триацетилцеллюлоза.
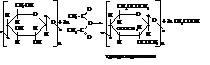 Из триацетилцеллюлозы изготавливают негорючую кинопленку и ацетатный шелк.
Из триацетилцеллюлозы изготавливают негорючую кинопленку и ацетатный шелк.
Огромное количество целлюлозы идет на изготовление бумаги, искусственных волокон (вискозный шелк). В больших количествах из клетчатки получают глюкозу и этиловый спирт. Сырьём в этом случае служит древесина, а не пищевые продукты, как при производстве этих веществ из крахмала.
| <== предыдущая страница | | | следующая страница ==> |
| АЛЬДЕГИДО- И КЕТОКИСЛОТЫ | | | ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. Гетероциклической называется любая циклическая молекула, которая содержит в цикле наряду с углеродными атомами хотя бы один неуглеродный |
Дата добавления: 2014-10-02; просмотров: 762; Нарушение авторских прав

Мы поможем в написании ваших работ!