
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. Гетероциклической называется любая циклическая молекула, которая содержит в цикле наряду с углеродными атомами хотя бы один неуглеродный
Гетероциклической называется любая циклическая молекула, которая содержит в цикле наряду с углеродными атомами хотя бы один неуглеродный, так называемый гетероатом.
Гетероциклические соединения широко распространены в природе в виде витаминов, алкалоидов, пигментов животных и растительных клеток, они играют важную роль в биологических процессах.
Наиболее хорошо изучены и широко распространены гетероциклические соединения кислорода, серы и азота.
Гетероциклические соединения могут быть классифицированы по общему числу атомов в цикле. Их может быть 3, 4, 5… и больше. Наиболее устойчивы пяти- и шестичленные гетероциклы. Кроме того, гетероциклы различают по природе входящих в них гетероатомов и их числу. Существуют также гетероциклические системы с конденсированными кольцами.
Весьма интересным и полезным является тот факт, что большая группа гетероциклических соединений в своём физическом и химическом поведении проявляет ароматический характер.
Номенклатура
Наиболее распространённые гетероциклические соединения обычно имеют тривиальные названия, которые закреплены за ними правилами ИЮПАК. Нумерация атомов начинается с гетероатома. Если в цикле несколько гетероатомов, то нумеруют их в следующем порядке: O, S, NH, N…
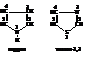
Используется также заменительная номенклатура («а»-номенклатура), когда гетероциклы рассматриваются как полученные из соответствующих углеродных структур в результате замещения в них атомов углерода на гетероатомы, наличие которых отмечается префиксами (кислорода – окса; серы – тиа; азота – аза и т.д.)
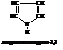
Основной путь составления названий гетероциклов – использование расширенной системы Ганча-Видмана. По этой системе гетероатомы обозначаются префиксами (как в «а»-номенклатуре), размер и степень насыщенности цикла – суффиксом.
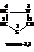
Совокупность используемых префиксов и суффиксов приводится в учебной и справочной литературе.
13.1 Пятичленные гетероциклические соединения
Наиболее простыми веществами этой группы являются фуран, тиофен и пиррол:
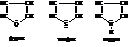
Причиной ароматичности является сопряжение π-электронов углеродных атомов цикла и двух электронов неподелённой пары гетероатома. Образование единой сопряжённой системы шести
р-электронов приводит как и в бензоле к плоской структуре кольца и усреднению длин связей, а также к выравниванию электронной плотности. Все три соединения в полной мере удовлетворяют правилу Хюккеля для ароматических систем. Поскольку помимо углеродов в цикл входят гетероатомы различной природы, равномерность распределения электронной плотности в циклах фурана, пиррола и тиофена, а, следовательно, и степень ароматичности гетероциклов ниже по сравнению с бензолом и она неодинакова для различных гетероциклов. Так, если энергия стабилизации для бензола
~ 150 кДж·моль-1, то для тиофена, пиррола и фурана она уменьшается соответственно до 130,0; 109,2 и 92.4 кДж·моль-1. Отсюда следует, что наиболее ароматичен тиофен, фуран же по своим свойствам больше похож на алифатические сопряженные диеновые соединения.
Методы получения
Общим способом получения является дегидратация соответствующих 1,4-дикетонов или диальдегидов, способных к кето-енольной таутомерии
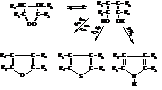
Фуран может быть получен пропусканием его альдегида, фурфурола, образующегося при дегидратации пентоз, над натронной известью:
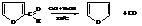
Тиофен в промышленности получают из бутана и бутиленов при нагревании их с серой до температуры 650…700 °С:
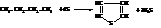
Химические свойства
Исходя из строения, фуран, тиофен и пиррол могут вступать в следующие типы реакций:
– реакции электрофильного замещения – как ароматические соеди-нения;
– реакции присоединения – как ненасыщенные соединения;
– реакции раскрытия цикла;
– реакции обмена гетероатома.
Реакции электрофильного замещения
Вследствие втягивания электронной пары гетероатомов в систему сопряжения ядро заряжается отрицательно и реакции электрофильного замещения протекают легче, чем с бензолом. Замещение практически всегда идёт в α-положении по отношению к гетероатому.
– Из-за сравнительно низкой ароматичности и протекания реакций раскрытия циклов в кислых средах (об этом – ниже) фуран и пиррол галогенируют и сульфируют в особых условиях, понижающих кислотность реакционной среды.
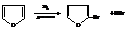
– Хлорирование пиррола проводится в мягких условиях хлористым сульфурилом в эфирном растворе при 0 °С.
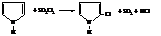
– Тиофен как наиболее ароматическое соединение, обладающее эффективной системой сопряжения, напоминает бензол. Он неацидофобен (не «боится» кислот) и в реакциях замещения активнее бензола
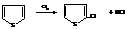
– Фуран и пиррол сульфируются комплексом SO3 и пиридина С5Н5N (пиридин – органическое основание)
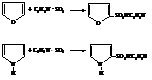
Тиофен же сульфируется легче бензола непосредственно серной кислотой.
– Азотная кислота разрушает фуран. Поэтому нитрогруппу вводят действием ацетилнитрита
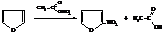
Тиофен нитруется азотной кислотой в уксусном ангидриде
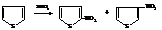
– Ацилирование всех трех соединений может проводиться ангидридами кислот
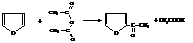
Реакции раскрытия цикла
В присутствии кислот электронная пара гетероатома изымается из системы сопряжения цикла на присоединение протона
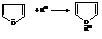
При этом система кольцевого сопряжения нарушается, цикл дестабилизируется и в кислой среде начинают протекать процессы осмоления (полимеризации) с раскрытием цикла. Ацидофобность особенно велика у фурана и пиррола, тиофен как наиболее ароматическое соединение неацидофобен.
Реакции присоединения
– Из трёх рассматриваемых гетероциклических соединений наименее ароматичен фуран. В реакциях присоединения он проявляет диеновый характер. Так, присоединение водорода по типу «1-4» к фурану происходит в присутствии никеля Ренея при температуре 100…150 °С и 100…150 атм.
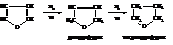
– Фуран вступает в реакцию диенового синтеза с малеиновым ангидридом (активный диенофил), присоединяясь по типу «1-4»
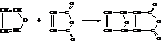
– Пиррол также способен присоединять водород в момент его выделения с образованием пирролина, гидрирование над платиной даёт пирролидин
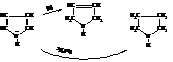
Получающийся пирролидин является более сильным основанием по сравнению с пирролом поскольку электронная пара азота в нём не участвует в образовании системы сопряжения как в пирроле и может быть использована на присоединение протона.
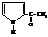
Поэтому в реакции с уксусным ангидридом образуются
2-ацетилпиррол (как с ароматическим соединением)
но N-ацетилпирролидин (как с амином)
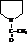
Алкилированные пиррольные циклы образуют основу многих биологически важных пигментов, в том числе гемина крови и хлорофилла.
Тиофен гидрируется трудно.
Реакция обмена гетероатомов (реакция Юрьева)
При 450 °С в паровой фазе над оксидом алюминия происходят взаимные переходы между фураном, тиофеном и пирролом.
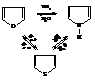
Реакции обратимы и выходы продуктов невелики. Это один из методов получения пиррола.
Другие реакции
– Окисление фурана даёт малеиновый ангидрид
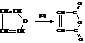
– При окислении фурфурола (2-фуранкарбальдегида) получается пирослизевая кислота
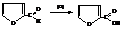
– Из-за понижения электронной плотности на азоте в результате включения его неподеленной электронной пары в систему сопряжения цикла и вследствие этого повышения подвижности водорода при нём пиррол проявляет очень слабые кислотные свойства (слабее фенола). Он вступает в реакции с сильными основаниями, замещая водород на металл.
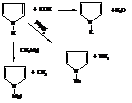
Соли пиррола используют в синтезах его N-замещённых.
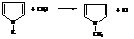
N-метилпиррол
Индол (бензопиррол) – это конденсированное гетероциклическое соединение.
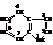
Строение индола следует из его синтеза путём замыкания в цикл орто-амино-β-хлорстирола под действием алкоголята натрия.
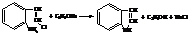
Существуют и другие способы синтеза индола. Реакции индола и его простых производных сходны с реакциями пиррола. Однако, из-за влияния бензольного кольца при электрофильном замещении предпочтительным является положение «3», а не «2» как у пиррола.
Индол в небольших количествах находится в каменноугольном дёгте. В небольшой концентрации имеет приятный запах. Содержится в эфирном масле жасмина и белой акации. Применяется в парфюмерии. Большое значение имеет целый ряд производных индола. Например,
3-индолилуксусная кислота или гетероауксин является гормоном роста растений, стимулятором корнеобразования.
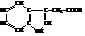
3-Гидроксииндол или β-индоксил, может существовать в двух таутомерных формах.
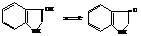
Щелочные растворы индоксила легко окисляются на воздухе в краситель индиго.
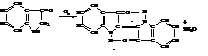 Это промышленный метод получения индиго. Индиго не растворимо в обычных растворителях, кислотах и щелочах, что затрудняет его применение в качестве красителя. Для окрашивания материала индиго восстанавливают в водорастворимую спиртовую форму (белое индиго), раствором которой пропитывают окрашиваемый матариал. Затем его вывешивают на воздух и под действием кислорода воздуха белое индиго окисляется в синее индиго. Такой способ окраски называют кубовым крашением.
Это промышленный метод получения индиго. Индиго не растворимо в обычных растворителях, кислотах и щелочах, что затрудняет его применение в качестве красителя. Для окрашивания материала индиго восстанавливают в водорастворимую спиртовую форму (белое индиго), раствором которой пропитывают окрашиваемый матариал. Затем его вывешивают на воздух и под действием кислорода воздуха белое индиго окисляется в синее индиго. Такой способ окраски называют кубовым крашением.
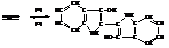
5,5`-индигодисульфокислота или индиго-кармин может использоваться для окраски пищевых продуктов.
Пятичленные гетероциклические соединения с несколькими гетероатомами
Гетероциклические соединения этого класса, имеющие ароматический характер, как правило, содержат один или несколько атомов азота. Их называют азолами и различают по природе второго гетероатома:
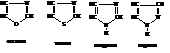
Пиразол
Пиразол и его производные встречаются в природе и применяются в качестве лекарственных препаратов и красителей. Получают пиразол действием диазометана на ацетилен
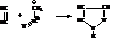
Пиразол является основанием и устойчив к действию окислителей, кислот и оснований. Поэтому его можно сульфировать и нитровать непосредственно кислотами. При гидрировании пиразола образуется пиразолин, а затем и пиразолидин:
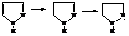
Пиразолин легко окисляется. Его оксопроизводное, пиразолон, лежит в основе получения многих лекарственных препаратов.
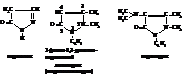
Тиазол
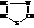
Ядро тиазола входит в состав многих природных соединений. При гидрировании тиазол даёт тиазолидин.
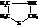
Первым открытым и практически используемым антибиотиком, который используется для лечения бактериальных инфекционных заболеваний, является пенициллин. Пенициллин является производным тиазолидина

Известны пять пенициллинов, различающихся радикалами R.
13.2 Шестичленные гетероциклические соединения
Пиридин
Пиридин – простейшее шестичленное азотсодержащее гетероцик-лическое соединение, обладающее ярко выраженным ароматическим характером.
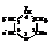
Основным источником пиридина является каменноугольная смола (≤ 0,1 %). Пиридин извлекают из неё водными растворами кислот и выделяют затем обработкой щёлочью. Большие потребности в пиридине и его гомологах обусловили развитие синтетических методов их получения. Наиболее развитым из них является синтез пиколина
(β-метилпиридина) из акролеина и аммиака.
Пиридин имеет сильный неприятный запах. tкип.= 115 °С,
tпл.= –38 °С. Смешивается с водой в любых соотношениях.
Химические свойства
Измерения электронной дифракции показало, что молекула пиридина плоская и представляет собой почти правильный шестиугольник. Это явная аналогия с бензолом – пиридин является ароматическим соединением. Ниже указаны длины связей (в нм) и распределение электронной плотности по различным положениям цикла пиридина: на углеродах цикла эти плотности меньше единицы.
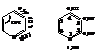
У бензола соответствующие плотности больше и равны единице. Поэтому пиридин менее реакционноспособен в реакциях электрофильного замещения (атакующая частица положительна), чем бензол, и легче бензола вступает в реакции нуклеофильного замещения. Из-за неравномерности распределения электронов положения 2,4,6 более удобны для атаки нуклеофильных, а положения 3 и 5 – электрофильных реагентов. Сильно повышенная эленктронная плотность на азоте свидетельствует об основных свойствах пиридина (способности его присоединять и удерживать протон).
Реакции электрофильного замещения
– При низких температурах галогены присоединяются к пиридину с образованием N-галогенидов, которые при нагревании превращаются в β-галогенпиридины.
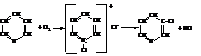
– Сульфирование и нитрование кислотами требует жёстких условий. Так, пиридин-3-сульфокислота образуется при нагревании пиридина с дымящей H2SO4 до температуры 220 °С в течении суток и в присутствии, кроме того, катализатора – сульфата ртути.
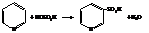
– Нитрование идёт при температуре 300 °С раствором нитрата калия в смеси концентрированных азотной и серной кислот и в присутствии железного катализатора
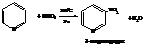
Реакции нуклеофильного замещения
– При нагревании пиридина с амидом натрия образуется
α-аминопиридин
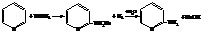
– При контакте паров пиридина с сухим КОН получается
α-гидроксипиридин
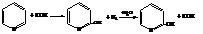
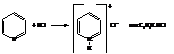
Реакции пиридина как третичного амина
Пиридин и его гомологи – слабые основания: константа основности пиридина kосновн.=1,7·10-9 (у анилина kосновн. =4,0·10-10)
Поэтому они легко дают соли с сильными кислотами.
С галоидными алкилами пиридин даёт галогеналкилаты, при нагревании которых происходит изомеризация с перемещением радикала в положения 2 или 4.
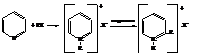
Отдельные представители
Пиридин используется в качестве растворителя и катализатора, как мягкое органическое основание.
α-Винилпиридин
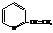
используется как сополимер с дивинилом при производстве специальных видов каучуков.
Пиперидин может быть получен при каталитическом гидрировании пиридина.
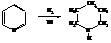
По аналогии с циклогексаном кольцо пиперидина имеет креслообразную форму. В химическом отношении ведёт себя как вторичный амин. Кольцо пиперидина входит в состав многих алкалоидов.
Никотиновая кислота (β-пиридинкарбоновая кислота)
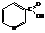
По химическим свойствам подобна кислотам бензольного ряда.
Никотиновая кислота содержится в печени, молоке, экстракте дрожжей.
Никотиновая кислота и ее амид под названием витамина РР используется для витаминизации хлеба и других пищевых продуктов. Витамин РР предохраняют животных и человека от заболевания пеллагрой (сухость кожи, изъязвление языка, поражение центральной нервной системы). Потребность в ней человека – 20…30 мг в сутки.
Кониин, никотин, анабазин
Эти три соединения являются алкалоидами. Алкалоиды – это особая группа азотистых органических соединений основного характера и сложного состава. Алкалоиды содержатся в растениях и часто обладают сильным физиологическим и фармакологическим действием. Большинство алкалоидов обладает оптической активностью.
Кониин, или 2-пропилпиперидин, содержится в болиголове.
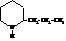
Маслообразная жидкость вращает плоскость поляризации влево.
Чрезвычайно ядовит, вызывает паралич двигательных нервных окончаний.
Никотин, или 3-[2-(N-метилпирролидин)] пиридин, находится в листьях и корнях табака. Окислением никотина получают никотиновую кислоту.
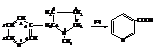
Небольшие количества никотина возбуждают нервную систему, большие – вызывают паралич дыхательных центров. Смертельная разовая доза для человека ~ 40 мг.
Никотин в больших количествах используется как инсектицид для борьбы с вредителями сельского хозяйства.
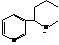
Анабазин, или 2-(3-пиридил)-пиперидин является изомером никотина. Очень ядовит и обладает высоким инсектицидным действием.
Хинолин
Хинолин, или бензопиридин, является аналогом нафталина, в котором одна группа –СН– в замещена атомом азота.
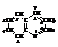
Хинолин впервые выделен из продуктов перегонки каменноугольной смолы.
Электрофильные заместители атакуют бензольную часть молекулы, нуклеофильные – пиридиновую. Это факт становится понятным в связи с тем, что электронная плотность на углеродах в бензоле выше, чем в пиридине. Хинолин, как и пиридин, слабое основание. Он вступает в соответствующие основаниям реакции.
Хинолин и его замещённые используются в производстве лекарственных препаратов и красителей.
Пиримидин
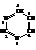
В химическом отношении сходен с пиридином. Имеет ароматический характер. Благодаря электронной плотности двух атомов азота является более сильным основанием по сравнению с пиридином.
Пурин
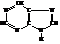
Пурин представляет собой конденсированную систему пиримидина имидазола. Обладает ароматическими свойствами, амфотерен.
Нуклеиновые гетероциклические основания (агликоны)
Известно, что главную роль в процессах синтеза белка и передачи наследственной информации играют нуклеиновые кислоты. Нуклеиновые кислоты – это биополимеры, макромолекулы которых состоят из многократно повторяющихся звеньев – нуклеотидов.
В состав нуклеотида – структурного звена нуклеиновых кислот – входят три составные части:
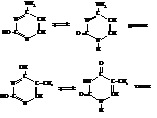
1)Азотистое основание – пиримидиновое или пуриновое. В нуклеиновых кислотах содержатся основания 4-х разных видов: два из них относятся к классу пуринов и два – к классу пиримидинов. Азот, содержащийся в циклах, придает молекулам основные свойства.
2)Моносахарид – рибоза или 2-дезоксирибоза. В зависимости от вида моносахарида, присутствующего в нуклеотиде, различают два вида нуклеиновых кислот – рибонуклеиновые кислоты (РНК), которые содержат остатки рибозы, и дезоксирибонуклеиновые кислоты (ДНК), содержащие остатки дизоксирибозы.
3)Остаток фосфорной кислоты. Нуклеиновые кислоты являются кислотами потому, что в их молекулах содержится остаток фосфорной кислоты.

Молекула ДНК человека – носитель генетической информации, которая записана в виде последовательности нуклеотидов с помощью генетического кода. В результате репликации ДНК происходит передача генов ДНК от поколения к поколению.
Пиримидиновые основания:
Пуриновые основания:
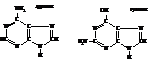
| <== предыдущая страница | | | следующая страница ==> |
| УГЛЕВОДЫ | | | ТЕРПЕНЫ |
Дата добавления: 2014-10-02; просмотров: 661; Нарушение авторских прав

Мы поможем в написании ваших работ!