
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Пути передачи сигнала с участием протеинкиназ
| Сигнал 1 Сигнал 2 Сигнал 3 Сигнал 4 Сигнал 5 ↓ ↓ ↓ ↓ ↓ Внеклеточная жидкость |
| Рецепторы Тирозиновые протеинкиназы рецепторов Плазматическая мембрана |
| ↓ ↓ ↓ ↓ ↓ Цитоплазма цАМФ цГМФ Са2+ Диацилглицерин ↓ ↓ ↓ ↓ ПК-А ПК-G Кальмодулин ПК-С ↓ ↓ ↓ ↓ ↓ К Л Е Т О Ч Н Ы Й О Т В Е Т |
ПК–А – цАМФ-зависимая протеинкиназа
ПК-G – цГМФ-зависимая протеинкиназа
ПК-С – протеинкиназа С
Обширная группа поверхностных рецепторов трансформирует внешний сигнал во внутриклеточный с участием ферментов. Строение и механизм действия мембранных рецепторов, ассоциированных с ферментативной активностью, отличаются большим разнообразием. Как правило, они обладают собственной каталитической активностью, проявляющейся только при связывании с ними лигандов.
К числу рецепторов-ферментов, осуществляющих передачу сигнала путем изменения протеинкиназной активности, относится семейство рецепторных тирозиновых протеинкиназ, способных аутофосфорилироваться, т.е. фосфорилировать самих себя по остаткам тирозина. Иначе говоря, здесь сам рецептор может являться мишенью. Эти рецепторы вовлечены в регуляцию таких важнейших процессов, как клеточное деление и дифференцировка. Стимуляция ассоциированной с рецептором протеинкиназы опосредована многими митогенными факторами и, в частности, гормоном инсулином, фактором роста эпидермиса, рецепторы к которому обнаружены на поверхности различных эпителиальных и фибробластных клеток, а также фактором роста нервов, тромбоцитарным фактором роста и др. Связывание рецептором ростовых факторов в конечном счете вызывает митогенный ответ, выражающийся на молекулярном уровне в индукции синтеза ДНК.
Рецепторы содержат короткий трансмембранный сегмент, наружный и цитоплазматический домены, отличающиеся у разных рецепторов длиной пептидной молекулы. Инсулиновый рецептор является гетеродимером, в котором отдельные цепи связаны между собой дисульфидными мостиками. Наружный, богатый цистеином домен рецепторного комплекса связывает лиганд, а цитоплазматический – проявляет киназную активность. Последний осуществляет фосфорилирование – перенос терминального фосфата с АТФ на гидроксильную группу остатка тирозина ряда белков внутри клетки (в том числе и на остатки тирозина того же белкового домена – аутофосфорилирование). Каталитический домен различных протеинкиназ (их известно сейчас более 70) имеет сходную аминокислотную последовательность, что позволяет предполагать происхождение всех от общего предка (рис.20).
Трансмембранный домен, расположенный между связывающим и эффекторным участками, осуществляет преобразование сигнала, передавая конформационное изменение, индуцированое связыванием агониста во внеклеточном домене, к внутриклеточному. В дальнейшем комплекс рецептора и лиганда подвергается эндоцитозу в окаймленных пузырьках и поглощается. Эндоцитоз играет важную роль как в расщеплении сигнальных молекул, так и в регуляции плотности рецепторов на поверхности клетки-мишени.
Вышедшие из-под контроля тирозиновые протеинкиназы, постоянно стимулируя процессы, приводящие к клеточному делению, играют важную роль в клеточной трансформации и канцерогенезе. В одних случаях аномально высокая активность тирозиновых протеинкиназ вызывается мутацией рецептора факторов роста, в других – продукцией большого числа рецепторов. Показано, что часто за опухолевую трансформацию отвечают онкогены, сходные с клеточными генами, кодирующими рецепторы для митогенных пептидов. В частности, идентифицирован вирусный онкоген, продукт которого является укороченным вариантом рецептора фактора роста эпидермиса. Некоторые аномальные рецепторы с тирозинкиназной активностью, кодируемые онкогенами, отличаются от нормального рецептора всего по одному аминокислотному остатку. Такого незначительного изменения, однако, достаточно, чтобы тирозиновая киназа была постоянно активной, а клетки вели себя так, как будто на них постоянно действует сигнал к пролиферации.
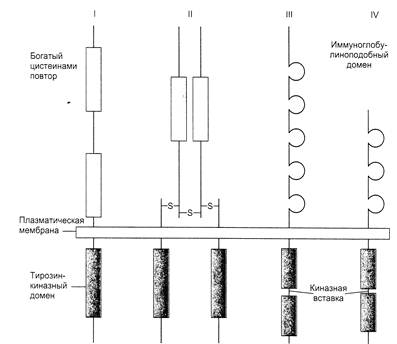
Рис.20.Структура различных рецепторных тирозиновых протеинкиназ
I – рецептор эпидермального фактора роста
II – рецептор инсулина
III –рецептор тромбоцитарного фактора роста
IV – рецептор фибробластного фактора роста
Другим типом рецепторов-ферментов являются гуанилатциклазы, катализирующие синтез вторичного мессенджера цГМФ из ГТФ. Опосредуя действие ряда пептидных гормонов, они участвуют в регуляции водно-солевого обмена и тонуса сосудов, вызывая диурез, расслабление гладких мышц и расширение сосудов. В частности, мембранные рецепторы для предсердного натриуретического пептида (ANP), выделяющегося клетками предсердий в ответ на повышение в них давления, характеризуются тем, что сами рецепторы непосредственно обладают гуанилатциклазной активностью. ANP-рецепторы состоят из внеклеточного ANP-связывающего домена, одной трансмембранной спирали и внутриклеточного гуанилатциклазного домена. Связывание ANP с рецептором стимулирует активность фермента и повышает внутриклеточный уровень вторичного мессенджера цГМФ без участия передающего сигнал белка. Физиологические эффекты цГМФ связаны с активацией клеточных протеинкиназ и фосфорилированием некоторых белков, в частности миозина гладкомышечных клеток сосудов.
Помимо рецепторов, обладающих собственной ферментативной активностью, существуют рецепторы, которые только в присутствии внешних сигналов приобретают способность связывать цитоплазматические протеинкиназы. Взаимодействуя с рецепторами, протеинкиназы фосфорилируют их и запускают цепь процессов, завершающихся определенной ответной реакцией клетки. Поскольку эти рецепторы сами не являются истинными протеинкиназами, а только связываются с ними, их называют рецепторами, ассоциированными с тирозинкиназами. Такой тип рецепторов свойствен гормону роста, пролактину, эритропоэтину, интерферону и многим цитокинам.
Третья система опосредованной рецепторами передачи сигнала внутрь клетки состоит из рецептора и регуляторного комплекса, образованного гуаниннуклеотидсвязывающими белками (G-белками) мембраны. В неактивном состоянии G-белок связан с ГДФ и не соприкасается с рецептором. Переход этих белков в активную форму, характеризующуюся высоким сродством к ГТФ, осуществляется при связывании мембранными рецепторами молекул агонистов (рис.21).
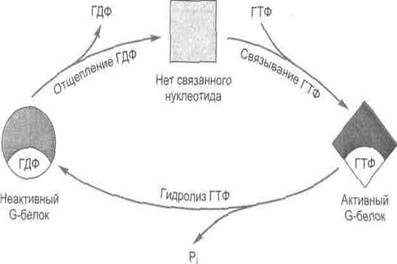
Рис.21 Цикл изменения активности G-белков
В передаче сигнала к самым разным клеточным мишеням участвует около 20 различных мембраносвязанных G-белков, относящихся к гетеротримерным белкам. Кроме того, существует класс мономерных ГТФ-связывающих белков, передающих сигналы на внутриклеточные эффекторы от тирозиновой протеинкиназы – рецептора фактора роста.
К семейству мембранных рецепторов, опосредующих агонистзависимую активацию гетеротримерных G-белков, относится более 500 представителей. Сигналами для этих рецепторов являются как разнообразные молекулы, например гормоны (адреналин, адренокортикотропин, соматотропин, вазопрессин, гонадотропин), нейромедиаторы (норадреналин, ацетилхолин, серотонин), опиоиды, так и свет, воспринимаемый фоторецепторами сетчатки глаза. Известно около 100 внеклеточных регуляторных веществ, для которых гетеротримерные G-белки служат посредниками между рецепторами плазматической мембраны и внутриклеточными процессами, которые они контролируют.
Рецепторы, сопряженные с G-белками, обладают общим структурным свойством – их трансмембранный домен семь раз пронизывает мембрану (серпантинные рецепторы). N-концевой участок рецептора находится на наружной стороне клеточной мембраны, а цитоплазматический домен содержит участки связывания G-белка (рис.22). Несмотря на общее сходство серпантинных рецепторов, в их структуре выявляются различия, благодаря которым они обладают высокой лигандной специфичностью.
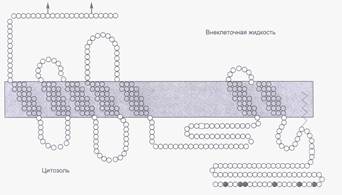
Рис. 22. Структура β-адренорецептора человека.
Стрелками указаны места гликозилирования внеклеточного домена.Трансмембранный домен пронизывает мембрану семь раз.
Передача сигнала к внутриклеточным мишеням осуществляется в цепи рецептор—>G-белок—>эффекторный белок. При участии одних G-белков происходит передача информации от поверхности клетки к молекулам ферментов, расположенным на внутренней стороне мембраны. Другие G-белки опосредуют свое действие через ионные каналы. Таким способом активные G-белки, модифицируя деятельность определенных ферментов и ионных каналов (они способны как активировать, так и ингибировать их), модулируют множество жизненно важных клеточных процессов. Перевод обратно в неактивное состояние осуществляется путем гидролиза ГТФ до ГДФ.
Гетеротримерные G-белки построены из трех нековалентно связанных между собой α-, β- и γ-субъединиц. В большинстве G-белков «рабочим элементом» является α-субъединица, так как здесь расположены центры, связывающие и гидролизующие ГТФ. Неактивные белки существуют главным образом в форме αβγ-гетеротримеров, при связывании же рецептором гормона или нейромедиатора (или при световой активации родопсина в фоторецепторах) в комплексе рецептор-G-белок происходит конформационное изменение, ускоряющее обмен ГДФ на ГТФ. Сродство α-субъединицы к ГДФ снижается и ГДФ отщепляется от ее активного участка. В свою очередь, с ним быстро связывается ГТФ, поскольку внутриклеточная концентрация ГТФ многократно превышает содержание ГДФ.
Активированный G-белок отделяется от рецептора и диссоциирует на две функциональные субъединицы: (α-субъединицу и комплекс βγ-субъединиц), которые далее диффундирует в плоскости мембраны к соответствующему эффектору (ферменту или ионному каналу). В зависимости от типа сигнальной системы с эффекторным белком будет взаимодействовать либо α-субъединица G-белка, либо βγ-комплекс. Причем показано, что у большинства G-белков с эффекторными белками при передаче сигнала взаимодействует диссоциированная α-субъединица. α-субъединица остается в активном состоянии до тех пор, пока входящая в ее состав ГТФаза не гидролизует ГТФ до ГДФ. Сразу после гидролиза ГТФ α-субъединица и βγ-димер вновь соединяются и возвращаются к рецептору.
На сегодняшний день обнаружено около 20 форм α-субъединиц, которые активируют различные эффекторные молекулы. На основе сходства первичной структуры они сгруппированы в 4 класса. Большинство форм α-субъединиц присутствуют во всех рецепторах, связанных с G-белками, но в клетках органов чувств встречаются уникальные α-субъединицы (табл10).
βγ-димеры также имеют несколько изоформ. Некоторые из них активируют эффекторы (например, мускариновые К+-каналы), другие модулируют функции α-субъединиц.
К мишеням G-белков, обладающих каталитической активностью, относятся аденилатциклаза, которая может ими стимулироваться или ингибироваться, фосфолипаза С и др. Активирование этих эффекторов сопровождается образованием (или расщеплением, как например при фоторецепции) молекул вторичных посредников. Эффекторы, представленные каналами (калиевыми или кальциевыми), отвечают на сигнал изменением ионной проницаемости.
Таблица 10
Гетеротримерные G-белки млекопитающих, классифицированные на основе их α-субъединицы
| G-белки | Активирующие рецепторы | Эффектор | Сигнальный путь |
| Gs | Для адреналина, нор-адреналина, гистамина, адренокортикотропного, лютеинизирующего, фолликулостимулиую-щего, тиреотропного гормонов и др. | Аденилатциклаза Са2+ -каналы | ↑ цАМФ ↑ Вход Са2+ клетку |
| Golf | Пахучих веществ | Аденилатциклаза | ↑ цАМФ (обоняние) |
| Gt1 (палоч-ки) | Фотонов | цГМФ-фосфодиэстераза | ↓ цГМФ (зрение) |
| Gt2 (колбоч-ки) | Фотонов | цГМФ-фосфодиэстераза | ↓ цГМФ (цветовое зрение) |
| Gi1,Gi2, Gi3 | Норадреналина, проста-гландинов, опиоидов, ангиотензина, многих пептидов | Аденилатциклаза Фосфолипаза С Фосфолипаза А2 К+-каналы | ↑ цАМФ ИТФ, ДАГ, Са2+ Высвобождение арахидоновой кислоты Поляризация мембраны |
| Gq | Ацетилхолина, адреналина | Фосфолипаза Сβ | ↑ИТФ ДАГ, Са2+ |
В настоящее время наиболее изученными являются два пути передачи внутриклеточных сигналов при помощи G-белков, в которых важнейшими компонентами являются вторичные посредники. В одной из таких систем вторичным мессенджером служит цАМФ, в другой действует комбинация трех различных вторичных мессенджеров: диацилглицерола – ДАГ, инозитолтрифосфата – ИТФ и ионов Са2+(рис.23).
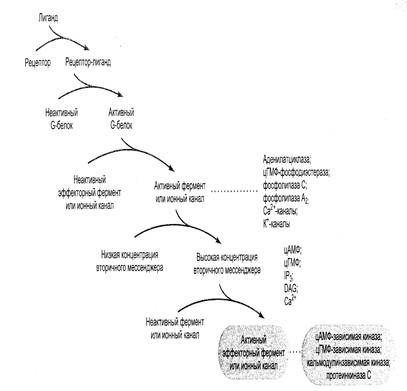
Рис.23. Схема каскада путей передачи сигнала при участии вторичных мессенджеров
Механизмы передачи внешнего сигнала в клетки с участием этих посредников имеют много общего. В обоих случаях мишенями G-белка являются ферменты, которые превращают молекулы вещества-предшественника в молекулы вторичного мессенджера. Сходство обнаруживается и в способе передачи сигнала – оно заключаются в конформационном изменении клеточных белков, переводящемих из неактивной формы в активную, что в итоге обеспечивает клеточный ответ, например секрецию, сокращение и т.д.
Несмотря на то, что число вторичных мессенджеров невелико, они способны регулировать множество разнообразных физиологических и биохимических процессов, характер которых зависит от природы активированных белков в клетке-мишени.
Рассмотрим путь передачи сигнала с участием цАМФ. Образование цАМФ, опосредованное связыванием рецептором молекулы лиганда, происходит в результате активирования фермента аденилатциклазы, локализованной на внутренней поверхности плазматической мембраны клеток. Фермент состоит из двух трансмембранных участков, каждый из которых включает шесть доменов. Аденилатциклаза присутствует в плазматической мембране всех клеток, но характер экспрессии этого белка варьирует, определяя специфическую активность разных клеток.
Аденилатциклаза катализирует образование цАМФ из АТФ в присутствии ионов Mg2+. Сопряжение между связыванием сигнальной молекулы и активацией аденилатциклазы осуществляется регуляторными G-белками. Рецепторы для агонистов, стимулирующих аденилатциклазу (позитивный контроль), активируют Gs-белки (s-стимуляция) с α-субъединицей типа αs, которая связывает ГТФ и затем отсоединяется от βγ-комплекса. Стимулирующее действие αs-субъединиц на некоторые формы аденилатциклазы может усиливаться βγ-димером. Прекращение сигнала достигается отделением αs-субъединицы от аденилатциклазы и гидролизом цАМФ фосфофиэстеразой.
Свободный цАМФ диффундирует в клетку, где в качестве вторичного посредника регулирует разные внутриклеточные процессы. У прокариот, например, цАМФ, связываясь со специфическим белком, оказывает влияние на ДНК. У эукариот цАМФ активирует протеинкину, которая, в свою очередь, фосфорилирует клеточные белки.
Протеинкиназа (цАМФ-зависимая аденилаткиназа, или А-киназа) представляет собой тетрамерный белок, состоящий в отсутствие цАМФ из двух регуляторных и двух каталитических субъединиц. У большинства типов клеток каталитическая субъединица одна и та же, а регуляторные – отличаются высокой специфичностью. Каталитические субъединицы лишены ферментативной активности и приобретают ее при диссоциации комплекса в результате конформационных изменений в молекулах, происходящих при связывания цАМФ регуляторными субъединицами.
Активная протенкинаэа катализирует перенос высокоэнергетической концевой фосфатной группы от АТФ на остатки серина или треонина клеточных белков. Одни белки, фосфорилируемые в разных тканях А-киназой, являются ферментами, другие образуют мембранные каналы, третьи – микротрубочки и т.д. Фосфорилирование ведет к изменению конформации белка, в результате чего изменяются его биологические свойства. Так, посредством протеинкиназ осуществляются многочисленные физиологические эффекты цАМФ: изменение ионной проницаемости мембран, активация или ингибирование внутриклеточных метаболических процессов и др.
Анализ первичной структуры цАМФ-зависимой и других классов протеинкиназ показал, что, несмотря на различия в их регуляторных свойствах, они характеризуются большим сходством в строении АТФ-связывающего домена и активного центра, обеспечивающего перенос фосфата с АТФ на белок-акцептор.
К числу гормонов, опосредующих свое действие на клетки через цАМФ, можно отнести адреналин, антидиуретический гормон, адренокортикотропный гормон, кальцитонин, кортиколиберин, глюкагон и др. (табл.11).
Таблица 11
| <== предыдущая страница | | | следующая страница ==> |
| Рецепторы для сигнальных молекул | | | Сигналы, опосредующие свое действие через ц-АМФ |
Дата добавления: 2014-10-02; просмотров: 561; Нарушение авторских прав

Мы поможем в написании ваших работ!