
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Термодинамические потенциалы
Критериями направления процесса и состояния равновесия в системе являются термодинамические потенциалы. В изолированных системах таким термодинамическим потенциалом является энтропия. Рассмотрим далее процессы в открытых и закрытых системах.
Вспомним математические формулировки I и II начал термодинамики:
dQ = dU + dA (2.23)
dQ £ TdS (2.24)
Объединим эти уравнения:
TdS ³ dU + dA (2.25)
Представим работу как сумму полезной работы А' и работы расширения РdV:
dA = d 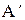 + РdV (2.26)
+ РdV (2.26)
Подставим (2.27) в (2.26):
TdS ³ dU + d 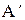 + РdV (2.27)
+ РdV (2.27)
или
- d 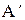 ³ dU - TdS + РdV (2.28)
³ dU - TdS + РdV (2.28)
Для равновесного процесса 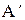 =
= 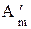 , а в (2.28) остается только знак “=“ :
, а в (2.28) остается только знак “=“ :
- d 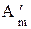 = dU - TdS + РdV (2.29)
= dU - TdS + РdV (2.29)
При Р,Т - const уравнение (2.30) можно представить в виде:
 |
-d 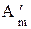 = d(U-TS+РV) или (2.30)
= d(U-TS+РV) или (2.30)
 |
-d 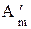 =d(H-TS) (2.31)
=d(H-TS) (2.31)
 а при V,T - const:
а при V,T - const:
-d 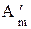 =d(U-TS) (2.32)
=d(U-TS) (2.32)
Из уравнений (2.30) - (2.32) следует, что в указанных условиях полезная работа обратимых процессов равна изменению некоторых функций состояния системы, а именно, при P,T - const
-d 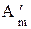 = dGP,T , (2.33)
= dGP,T , (2.33)
где G = U -TS + РV (2.34)
или
G = Н -TS (2.35)
а при V,T -const
-d 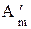 = dFV,T, (2.36)
= dFV,T, (2.36)
где F= U-TS (2.37)
Из сравнений (2.34) и (2.37):
G = F + РV (2.38)
Функция G называется энергией Гиббса, или изобарно-изотермическим потенциалом, или просто изобарным потенциалом.
Функция F называется энергией Гельмгольца, или изохорно-изотер-мическим потенциалом, или просто изохорным потенциалом.
Как следует из приведенного выше вывода, изобарный и изохорный потенциалы являются функциями состояния системы при постоянстве указанных параметров.
Функции Гиббса и Гельмгольца являются важнейшими термодинамическими характеристиками процессов в указанных условиях и широко используются в анализе термодинамической вероятности процессов.
Покажем далее, каким образом используют данные термодинамические потенциалы в качестве критериев возможности осуществления различных процессов. Из уравнений (2.33) и (2.36), обобщённо для обратимых и необратимых процессов:
dGP,T £ -d  (2.39)
(2.39)
dFV,T £ -d  (2.40)
(2.40)
Физический смысл функций Гиббса и Гельмгольца состоит в том, что они составляют ту долю энергии системы, которая может переходить в полезную работу.
Существует множество процессов, в которых единственным видом работы является работа расширения, а полезная работа  =0 (например, при химической реакции).
=0 (например, при химической реакции).
Для таких систем:
dGP,T £ 0, DGP,T£ 0 (2.41)
dFV,T £ 0, DFV,T£ 0 (2.42)
Из этих неравенств следует, что при необратимом самопроизвольном процессе в изобарно-изотермических условиях изобарный потенциал системы уменьшается, а в условиях равновесия остается постоянным и минимальным (dGP,T =0). Аналогично при V, T - const в состоянии равновесия dFV,T = 0, а при необратимом самопроизвольном процессе F уменьшается.
Изобразим графически эти критерии направления процесса и состояния равновесия в системе, приведя здесь же рассмотренный ранее критерий для изолированных систем (энтропия), рис. 2.2.
Изменение функций Гиббса и Гельмгольца в ходе процессов, протекающих в условиях постоянства соответствующих параметров, на основании уравнений (2.34), (2.35) и (2.37), можно рассчитать по термодинамическим данным процесса (т.е. зная тепловой эффект процесса при постоянном давлении, или, иначе говоря, - изменение энтальпии, а также изменение энтропии и внутренней энергии):
P, T = const V, T = const U, V = const
G F S
A C A C В
B B A C

путь процесса
Рис.2.2. Критерии направления процесса и состояния равновесия.
АВ - необратимый самопроизвольный процесс
ВС - необратимый не самопроизвольный процесс
(·)В - состояние равновесия.
DGP,T = DU - TDS + pDV (2.43)
или DGP,T = DH - TDS (2.44)
и DFV,T = DU -TDS (2.45)
Из последнего уравнения выразим DU:
DU = DF + TDS (2.46)
Анализ этого уравнения показывает, что изменение внутренней энергии при Т = const для обратимого процесса складывается из свободной энергии DF (которая может быть превращена в полезную работу) и связанной энергии ТDS (которая может выделяться или поглощаться в виде теплоты).
Приведенные выше уравнения позволили составить таблицы стандартных величин DG0298 и DF0298 для многих веществ. Они относятся, как и энтальпии, к реакциям образования данного химического соединения при стандартных условиях из химических элементов, взятых в стандартном состоянии.
Расчеты значений свободной энергии Гиббса для любой гипотетической реакции позволяют судить о возможности ее осуществления в данных изобарно-изотермических условиях, способности данных веществ вступать в химическую реакцию. Это определяет широту использования энергии Гиббса для анализа природных и искусственных химических процессов.
Энергию Гиббса, в связи с этим, называют мерой химического сродства.
В качестве примера рассмотрим вопрос: благоприятствует ли протеканию реакции
Ag + ½ Cl2 = AgCl (2.47)
понижение температуры, если известно, что стандартное изменение энтропии реакции ΔSo = -57,91 Дж/моль?
Решение. Температурный коэффициент энергии Гиббса реакции определяется уравнением:
∂ΔGo /∂T = -ΔSo (2.48)
Отсюда, ∂ΔGo /∂T = 57,91. (2.49)
Положительное значение производной говорит о том, что с ростом температуры энергия Гиббса будет увеличиваться, а с понижением – уменьшаться. Поскольку возможность самопроизвольного протекания процесса характеризуется снижением энергии Гиббса, следовательно, понижение температуры будет благоприятствовать реакции.
| <== предыдущая страница | | | следующая страница ==> |
| Влияние давления на энтропию. Гипотеза Капустинского о состоянии вещества в глубинных зонах Земли | | | Свободная энергия Гиббса и закономерности появления самородных элементов |
Дата добавления: 2014-10-02; просмотров: 535; Нарушение авторских прав

Мы поможем в написании ваших работ!