
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Уравнение (3.33) является уравнением изобары химической реакции в интегральной форме
Можно вычислять КPи графически. Для этого возьмем неопределенный интеграл от (3.30):
lgKP = lgB -  , (3.34)
, (3.34)
где lgB - постоянная интегрирования. В соответствии с уравнением (3.34), график в осях координат lgKP- 1/Т представляет собой прямую линию с угловым коэффициентом, равным  .
.
По графику можно определить КPпри заданном значении Т и тепловой эффект реакции DН. Уравнение (3.33) справедливо в узком интервале температур, поскольку принято, что DН = const.
Значение постоянной интегрирования lgB устанавливается следующим образом. Приравняем правые части уравнений (3.15) и (3.17), перейдя к десятичным логарифмам:
DG0 = - 2,3RT lgK0P
и DG0 =DН0 - TDS0
Получим:
- 2,3RT lnK0P= DН0 - TDS0 , откуда
lgK0P= 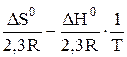
|
(3.35)
Сравнение (3.34) и (3.35) дает
 (3.36)
(3.36)
Уравнение (3.35) позволяет рассчитывать константы равновесия химических реакций по термодинамическим данным, имеющимся в справочной литературе. При этом необходимо учитывать, что для более точного расчёта константы равновесия реакции при температуре Т необходимо в уравнении (3.35) использовать ΔS0T =f(T) [см. уравнение (3.18)] и ΔН0Т =f(T) [см. уравнения (1.63) и (1.64)]. Это особенно важно, когда интервал температур составляет сотни или тысячи градусов. Подставляя указанные функции в уравнение (3.35), получают общее уравнение для расчета константы равновесия. Оно содержит ряд коэффициентов, являющихся функциями температуры. Тёмкин и Шварцман составили таблицы для их расчёта, которые приведены в справочниках физико-химических величин. Поэтому метод расчёта констант равновесия с использованием этих данных назван методом Тёмкина – Шварцмана. Метод широко используется и дает достаточно точные результаты.
| <== предыдущая страница | | | следующая страница ==> |
| Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции | | | Химическое равновесие гетерогенных химических реакций |
Дата добавления: 2014-10-02; просмотров: 524; Нарушение авторских прав

Мы поможем в написании ваших работ!