
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химическое равновесие гетерогенных химических реакций
Гетерогенными называются реакции, в которых компоненты находятся в разных фазах. Природные процессы в большинстве случаев гетерогенны. Для гетерогенных процессов условие равновесия (2.70):

сохраняется. Химические потенциалы веществ выражаются теми же уравнениями [(2.77) - (2.81)]. Химические потенциалы чистых веществ равны стандартным химическим потенциалам. Активности чистых твердых и жидких веществ равны единице.
В выражение закона действующих масс в этом случае входят активности веществ в конденсированных фазах и летучести (или давления) компонентов в газовой фазе.
Рассмотрим ряд примеров.
Пример 1. Химическое равновесие гетерогенной реакции с участием двух монооксидов свинца - красной и желтой разновидности при 298 К и Р = 1 атм:
PbOкp « PbOж (3.37)
Константа равновесия этой реакции по закону действующих масс:
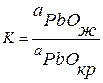 (3.38)
(3.38)
Так как атв = 1, то два чистых твердых вещества будут находиться в равновесии, когда
DGТ,реакц. = DG0Т = 0.
Для данной реакции изменение энергии Гиббса можно вычислить на основании данных об энергиях Гиббса для процессов образования веществ, ΔGf :
DG0Т = DGf, PbOж -DGf, PbOкр = -188,5 -(-189,3) = +0,8 кДж/моль
Положительное значение энергии Гиббса реакции говорит о том, что более устойчивой оказывается фаза PbOкрасн.
Этот метод удобен для определения относительной устойчивости любых полиморфных веществ при стандартных условиях.
Пример 2. Если в реакции участвуют газообразные вещества, то равновесие может быть достигнуто путем изменения парциального давления этого газа. В качестве примера рассмотрим равновесие в условиях земной поверхности оксида железа FeO по отношению к сидериту FeCO3:

 FeO(т) + СО2(г) FeCO3(т) (3.39)
FeO(т) + СО2(г) FeCO3(т) (3.39)
Константа равновесия этой реакции:
 (3.40)
(3.40)
Поскольку активности твердых веществ при общем давлении 1 атм равны единице, то это выражение упрощается:
 (3.41)
(3.41)
Таким образом, реакция оказывается равновесной лишь при одном определенном парциальном давлении РСО2. По справочным данным, стандартный изобарный потенциал реакции
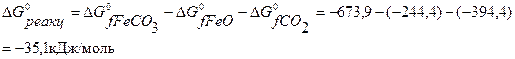
Тогда из уравнения стандартной изотермы (3.15) равновесное  атм. Полное уравнение изотермы данной реакции:
атм. Полное уравнение изотермы данной реакции:
 (3.42)
(3.42)
Поскольку парциальное давление СО2 в атмосфере,  , составляет примерно 10-3,5 атм, то из анализа уравнения (3.42) следует, что в условиях земной поверхности соединение FeO неустойчиво по отношению к FeCO3 и равновесие реакции (3.39) смещено вправо.
, составляет примерно 10-3,5 атм, то из анализа уравнения (3.42) следует, что в условиях земной поверхности соединение FeO неустойчиво по отношению к FeCO3 и равновесие реакции (3.39) смещено вправо.
Пример 3. При контакте твёрдого осадка ВаСО3 с природными водами, содержащими ионы SO42-и СО32- , возможен переход по уравнению:

 ВаСО3(т)+ SO42-(aq) BaSO4(т) + CO32-(aq) (3.43)
ВаСО3(т)+ SO42-(aq) BaSO4(т) + CO32-(aq) (3.43)
Стандартный изобарный потенциал реакции DG0298=—6,12 кДж/моль. Константа равновесия, выраженная через активности веществ:
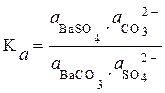 (3.44)
(3.44)
Т.к. активности чистых твердых веществ аВаSO4(т)=1 и аВаСO3(т)=1, то
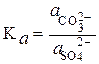 (3.45)
(3.45)
По уравнению изотермы Вант-Гоффа:
DG=DG0+ RT ln  , (3.46)
, (3.46)
где
DG0= - RT lnKa = - 6120 Дж/моль (3.47)
Из (3.47) можно рассчитать константу равновесия химической реакции при стандартных условиях Кa =11,8 и подставить найденное значение в уравнение изотермы:
DG=RT ln  — RT ln11,8 (3.48)
— RT ln11,8 (3.48)
где  — неравновесные активности ионов в воде.
— неравновесные активности ионов в воде.
Если их отношение в воде будет меньше равновесных:
 <11,8 , то DG реакции, в соответствии с уравнением (3.48), будет отрицательным, т.е. равновесие реакции (3.43) смещается вправо, происходит осаждение сульфата бария. Этот простейший анализ объясняет причину кристаллизации сульфата бария в природных условиях даже из углекислых растворов, имеющих значительную концентрацию ионов
<11,8 , то DG реакции, в соответствии с уравнением (3.48), будет отрицательным, т.е. равновесие реакции (3.43) смещается вправо, происходит осаждение сульфата бария. Этот простейший анализ объясняет причину кристаллизации сульфата бария в природных условиях даже из углекислых растворов, имеющих значительную концентрацию ионов  и малое содержание
и малое содержание  .
.
| <== предыдущая страница | | | следующая страница ==> |
| Уравнение (3.33) является уравнением изобары химической реакции в интегральной форме | | | ГЛАВА 4. ФАЗОВЫЕ РАВНОВЕСИЯ |
Дата добавления: 2014-10-02; просмотров: 421; Нарушение авторских прав

Мы поможем в написании ваших работ!