
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Кривые титрования. Для того чтобы наглядно представить себе, что происходит при титровании, можно воспользоваться кривой титрования
Для того чтобы наглядно представить себе, что происходит при титровании, можно воспользоваться кривой титрования. С помощью кривых титрования можно, например, объяснить, почему для титрования данного вещества подходит один, но не подходит другой индикатор, оценить индикаторную погрешность титрования.
Кривая титрования - график зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта реакции, от степени протекания процесса титрования (например, от количества добавленного титранта).
По оси абсцисс при построении кривых титрования обычно откладывают объём добавленного стандартного раствора титранта или степень оттитрованности (f).
f = 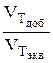 f =
f = 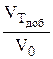 (если
(если 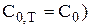
На оси ординат, в случае кривых титрования для кислотно-основного титрования, откладывают значение рН раствора.
В зависимости от определяемого вещества и титранта различают 4 основных случая кислотно-основного титрования и, соответственно, 4 типа кривых титрования:
· титрование сильной кислоты сильным основанием,
· титрование сильного основания сильной кислотой,
· титрование слабой кислоты сильным основанием,
· титрование слабого основания сильной кислотой.
Теоретически можно представить себе и титрование слабой кислоты слабым основанием или титрование слабого основания слабой кислотой. Однако, на практике (во всяком случае, в химических методах анализа) такое титрование не используется.
Титрование сильной кислоты сильным основанием и сильного основания слабой кислотой
Рассмотрим кривую титрования 0,10 М HCl при использовании в качестве титранта 0,10 М NaOH.
В любой кривой титрования можно условно выделить 4 участка:
· исходная точка;
· участок до скачка титрования;
· скачок титрования, включая точку эквивалентности;
· участок после скачка титрования.
Скачком титрования называется участок кривой титрования, соответствующий резкому изменению свойств системы (в случае кислотно-основного титрования - резкому изменению рН) вблизи точки эквивалентности (обычно в интервале значений степени оттитрованности 0,999 - 1,001).
Расчёты, необходимые для построения кривой титрования, удобно представить в виде таблицы (табл. 13.1). Исходный объём раствора титруемого вещества составляет 100,0 мл. Полученная кривая титрования представлена на рис. 13.1. На этом же рисунке представлена кривая титрования 0,10 М NaOH 0,10 M раствором HCl. Кривые титрования сильной кислоты сильным основанием и сильного основания сильной кислотой симметричны друг другу. Точка эквивалентности совпадает с точкой нейтральности.
Табл. 13.1
Расчёты для построения кривой титрования 0,10 М HCl
0,10 М раствором NaOH
 , мл , мл
| f | Формула для расчёта рН | рН |
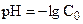
| 1,00 | ||
| 50,0 | 0,500 | 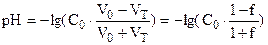
| 1,48 |
| 90,0 | 0,900 | аналогично | 2,28 |
| 99,0 | 0,990 | аналогично | 3,30 |
| 99,9 | 0,999 | аналогично | 4,30 |
| 100,0 | 1,000 | 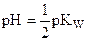
| 7,00 |
| 100,1 | 1,001 | 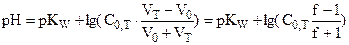
| 9,70 |
| 101,0 | 1,010 | аналогично | 10,7 |
| 110,0 | 1,100 | аналогично | 11,7 |
| 150,0 | 1,500 | аналогично | 12,3 |
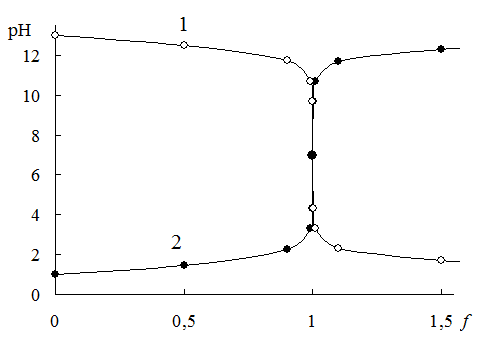
Рис. 13.1. Кривые титрования 0,10 М NaOH 0,10 M раствором HCl (1) и 0,10 M HCl 0,10 M раствором NaOH (2)
Титрование слабой кислоты сильным основанием и слабого основания сильной кислотой
Рассмотрим кривую титрования 0,10 М HCOOH при использовании в качестве титранта 0,10 М NaOH. Расчёты, необходимые для построения кривой титрования, представлены в табл. 13.2, а сама кривая - на рис. 13.2. На этом же рисунке приведена кривая титрования слабого основания (NH3 pKBH+ = 9,24) сильной кислотой. Кривые титрования слабой кислоты сильным основанием и слабого основания сильной кислотой несимметричны относительно точки эквивалентности, которая не совпадает с точкой нейтральности. Величина скачка титрования меньше, чем для, соответственно, кривой титрования сильной кислоты и сильного основания.
На рис. 13.2. показаны также области перехода окраски метилового оранжевого и фенолфталеина. Метиловый оранжевый не подходит для обнаружения конечной точки титрования HCOOH, но подходит для NH3, в то время как фенолфталеин можно использовать в качестве индикатора при титрования HCOOH, но нельзя при титровании NH3. Таким образом, индикаторы, переход окраски у которых происходит в слабокислой среде, нельзя использовать для обнаружения конечной точки при титровании слабых кислот, а индикаторы, у которых интервал перехода окраски находится в слабощелочной среде - при титровании слабых оснований.
Табл. 13.2
| <== предыдущая страница | | | следующая страница ==> |
| Феноловый красный | | | Расчёты для построения кривой титрования. 0,10 М HСООН (рКа = 3,75) 0,10 М раствором NaOH f Компонент, определяющий рН Формула для расчёта рН рН слабая кислота HCOOH |
Дата добавления: 2014-10-10; просмотров: 713; Нарушение авторских прав

Мы поможем в написании ваших работ!