
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Расчёты для построения кривой титрования. 0,10 М HСООН (рКа = 3,75) 0,10 М раствором NaOH f Компонент, определяющий рН Формула для расчёта рН рН слабая кислота HCOOH
0,10 М HСООН (рКа = 3,75) 0,10 М раствором NaOH
| f | Компонент, определяющий рН | Формула для расчёта рН | рН |
| слабая кислота HCOOH | 
| 2,38 | |
| 0,100 | буферная смесь HCOOH/HCOO- | 
| 2,80 |
| 0,500 | то же | аналогично | 3,75 |
| 0,900 | то же | аналогично | 4,74 |
| 0,990 | то же | аналогично | 5,75 |
| 1,00 | слабое основание HCOO- | pH = 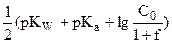
| 8,22 |
| 1,01 | сильное основание OH- | 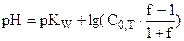 см. табл. 13.1 см. табл. 13.1
| 10,7 |
| 1,10 | то же | аналогично | 11,7 |
| 1,50 | то же | аналогично | 12,3 |
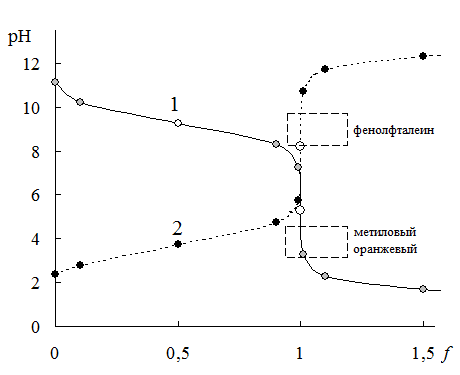
Рис. 13.2. Кривые титрования слабого основания (0,10 M NH3 pKBH+=9,24) сильной кислотой (1) и слабой кислоты (0,10 M HCOOH pKa=3,75) сильным основанием (2)
Титрование многоосновных кислот и многокислотных оснований, а также смесей кислот или смесей оснований
Представим себе, что мы титруем двухосновную кислоту H2A, превращение которой в НА- характеризуется константой Ka1, а превращение НА- в A2- - константой Ka2
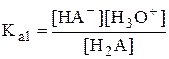
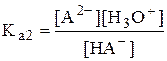
Определим, при каком соотношении данных констант, H2A можно оттитровать вначале до HA-, а затем до A2-, т.е. можно получить кривую титрования с двумя отчётливыми скачками титрования. Допустим, что нас удовлетворяет погрешность титрования H2A по первой ступени менее 1%, иначе говоря, к концу титрования степень превращения H2A в НА- составит более 99%, а НА- в A2- менее 1%
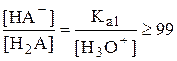

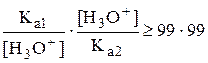
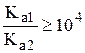
Таким образом, чтобы оттитровать двухосновную кислоту по первой ступени с погрешностью менее 1%, необходимо, чтобы константы кислотности по первой и второй ступени отличались на 4 порядка и более. При допустимой погрешности 0,1% константы должны отличаться на 6 порядков и т.д.
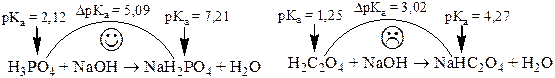
Закономерности, характерные для многоосновных кислот, остаются справедливыми для многокислотных оснований, а также для смесей кислот или смесей оснований. В качестве примера рассмотрим титрование раствора, содержащего карбонат-ион (например, 0,10 М Na2CO3). Расчёт рН для основных точек кривой титрования приведен в табл. 13.3. Кривая титрования показана на рис. 13.3. На кривой имеются 2 скачка титрования; первый скачок можно обнаружить при использовании фенолфталеина, а второй - метилового оранжевого.
Табл. 13.3
Дата добавления: 2014-10-10; просмотров: 411; Нарушение авторских прав

Мы поможем в написании ваших работ!