
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Расчёты для построения кривой титрования. 0,10 М Na2CO3 0,10 М раствором HCl f Компонент, определяющий рН Формула для расчёта рН (pKa1 = 6,35; pKa2 = 10,32) рН слабое
0,10 М Na2CO3 0,10 М раствором HCl
| f | Компонент, определяющий рН | Формула для расчёта рН (pKa1 = 6,35; pKa2 = 10,32) | рН |
| слабое основание СO32- | 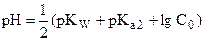
| 11,7 | |
| 0,50 | буферная смесь HCO3-/CO32- | 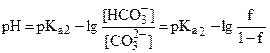
| 10,4 |
| 0,90 | то же | аналогично | 9,37 |
| 0,95 | то же | аналогично | 9,04 |
| 1,00 | амфолит HCO3- | 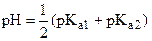
| 8,34 |
| 1,05 | буферная смесь H2CO3/HCO3- | 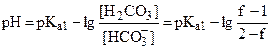
| 7,63 |
| 1,50 | то же | аналогично | 6,35 |
| 1,90 | то же | аналогично | 5,40 |
| 1,99 | то же | аналогично | 4,45 |
| 2,00 | слабая кислота H2CO3 | 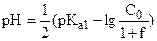
| 3,91 |
| 2,01 | сильная кислота | 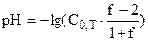
| 3,48 |
| 2,10 | то же | аналогично | 2,48 |
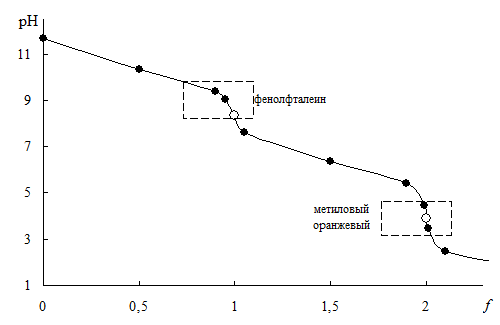
Рис. 13.3 Кривая титрования 0,10 М Na2CO3 0,10 М раствором HCl
13.4. Факторы, влияющие на величину скачка титрования
На величину скачка титрования в кислотно-основном титровании влияют:
· концентрация титруемого вещества и титранта,
· сила титруемой кислоты или основания,
· температура,
· ионная сила раствора.
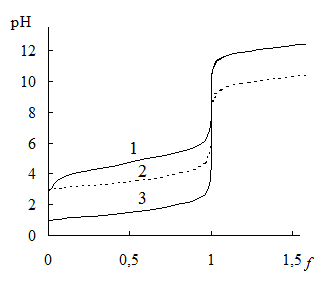 Рис. 13.4. Кривые титрования 0,1М CH3COOH 0,1М NaOH (1), 0,001М HCl 0,001М NaOH (2) и 0,1М HCl 0,1М NaOH (3)
Рис. 13.4. Кривые титрования 0,1М CH3COOH 0,1М NaOH (1), 0,001М HCl 0,001М NaOH (2) и 0,1М HCl 0,1М NaOH (3)
|
При уменьшении концентрации титруемого вещества и титранта величина скачка титрования уменьшается (рис. 13.4), поэтому кислотно-основное титрование нельзя использовать для определения веществ в сильно разбавленных растворах. Величина скачка титрования также становится меньше при уменьшении силы титруемой кислоты или основания (рис. 13.4). Прямое титрование таких кислот как H3BO3 (pKa = 9,2) или NH4+ (pKa = 9,24) в водных растворах с удовлетворительной погрешностью невозможно и поэтому для их определения используют специальные приёмы.
Температура и ионная сила влияют на величину скачка титрования менее заметно, чем концентрация или сила титруемой кислоты или основания. При повышении температуры константа автопротолиза воды увеличивается, поэтому величина скачка кислотно-основного титрования в водном растворе уменьшается. Аналогичным образом влияет на величину скачка титрования ионная сила раствора.
| <== предыдущая страница | | | следующая страница ==> |
| Расчёты для построения кривой титрования. 0,10 М HСООН (рКа = 3,75) 0,10 М раствором NaOH f Компонент, определяющий рН Формула для расчёта рН рН слабая кислота HCOOH | | | Погрешности титрования |
Дата добавления: 2014-10-10; просмотров: 529; Нарушение авторских прав

Мы поможем в написании ваших работ!