
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Перманганатометрическое титрование
Перманганатометрическим титрованием называется титриметрический метод анализа, основанный на использовании в качестве титранта KMnO4.
Перманганатометрическое титрование чаще всего проводят в кислой среде, реже - в нейтральной или щелочной. Для создания кислой среды применяют серную кислоту. Азотная кислота, в особенности содержащая оксиды азота, сама является сильным окислителем, а хлороводородная, наоборот, может окисляться титрантом.
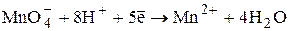 E0 = +1,51В
E0 = +1,51В
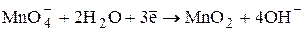 E0 = +0,60В
E0 = +0,60В
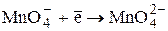 E0 = + 0,54В
E0 = + 0,54В
Стандартный раствор KMnO4 является вторичным. Приготовление и стандартизация данного раствора имеет ряд особенностей. Свежеприготовленный раствор кипятят в течение 10 минут, а затем выдерживают несколько дней для того, чтобы прошли процессы окисления органических веществ, которые могут содержаться в воде. Образовавшийся осадок MnO2 следует обязательно удалить, так как данное вещество катализирует восстановление перманганата. Диоксид марганца отфильтровывают с помощью стеклянного (но не бумажного!) фильтра.
Стандартные растворы KMnO4 следует хранить в сосудах тёмного стекла с притёртыми пробками. Концентрация КMnO4 в растворе с течением времени постепенно уменьшается. Особенно неустойчивы разбавленные растворы KMnO4. При длительном хранении раствора КMnO4 на стенках сосуда может образовываться коричневый налёт MnO2. Сосуды, стенки которых покрыты таким налётом, использовать для дальнейшего хранения раствора KMnO4 нельзя.
Стандартизацию растворов KMnO4 проводят каждый раз перед применением. В качестве первичного стандартного вещества используют Na2C2O4, а также H2C2O4×2H2O, Fe, As2O3 и другие вещества. Оксалат натрия негигроскопичен, легко подвергается очистке, разрушается лишь при температуре больше 240 °С. Реакция взаимодействия между перманганат- и оксалат-ионами
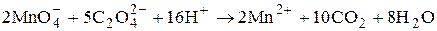 ,
,
несмотря на большое значение ЭДС, протекает медленно, поэтому её проводят при нагревании (около 70°С). Данная реакция является автокаталитической - роль катализатора выполняют ионы Mn2+, образующиеся в ходе реакции. Кипятить раствор нельзя, так как оксалаты и щавелевая кислота при этом разрушаются.
Н2С2О4 ® Н2О + СО2 + СО
Индикаторы в перманганатометрическом титровании обычно не используют (если только используемые растворы не являются слишком разбавленными, исходная концентрация перманганата должна быть не меньше, чем 0,02 М). Конечную точку титрования обнаруживают по появлению или исчезновению окраски KMnO4.
При титровании раствором KMnO4 используют бюретки со стеклянным краном. В бюретках с резиновыми трубками концентрация КMnO4 изменяется в результате окисления резины. Используемые в работе растворы KMnO4 (например, 0,1 М 1/5 KMnO4) интенсивно окрашены, поэтому отсчёты показаний по шкале бюретки делают по верхнему мениску жидкости.
В перманганатометрии используют различные приёмы титрования. При прямом титровании раствор определяемого вещества титруют стандартным раствором KMnO4, например:


При обратном перманганатометрическом титровании к раствору определяемого вещества добавляют избыток стандартного раствора KMnO4 и после протекания реакции непрореагировавший KMnO4 титруют стандартным раствором щавелевой кислоты, соли Мора или определяют его иодометрически. Обратное перманганатометрическое титрование используется, например, при определении нитритов. Прямое перманганатометрическое титрование раствора нитрита стандартным раствором KMnO4 невозможно, поскольку при добавлении к раствору титруемого вещества серной кислоты протекает реакция
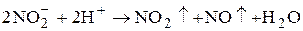
Поэтому к анализируемому раствору добавляют избыток стандартного раствора КMnO4 и через некоторое время избыток КMnO4 титруют стандартным раствором соли Мора или щавелевой кислоты.
Титрование заместителя используют при определении сильных восстановителей, окисляющихся кислородом воздуха. Например, для определения ионов Cr2+ к анализируемому раствору добавляют Fe3+ и титруют образовавшиеся ионы Fe2+ стандартным раствором KMnO4.
Косвенное перманганатометрическое титрование используется для определения ионов металлов, образующих малорастворимые оксалаты (Ca2+, Ba2+, Mg2+, Zn2+ и др.). Определяемый ион осаждают в виде оксалата, осадок отделяют, растворяют в растворе H2SO4 и титруют выделившуюся щавелевую кислоту стандартным раствором KMnO4.
Перманганатометрическое титрование сравнительно редко используется для определения органических веществ. Взаимодействие KMnO4 с органическими веществами, особенно в кислой среде, протекает очень сложно, медленно и затрагивает не какую-то определённую функциональную группу, а всю молекулу в целом. Обычно перманганатометрическое определение органических веществ проводится в щелочной среде. Таким способом определяют спирты, альдегиды, карбоновые кислоты. Например

Определение проводят способом обратного титрования. К анализируемому раствору добавляют щёлочь и стандартный раствор КMnO4 в избытке. После окончания реакции раствор подкисляют и избыток КMnO4 титруют стандартным раствором соли Мора или щавелевой кислоты.
Перманганатометрическое титрование не имеет широкого применения в фармацевтическом анализе. Это связано, во-первых, с малым числом возможных определяемых веществ и, во-вторых, с неустойчивостью раствора KMnO4. Основными объектами, анализируемыми перганганатометрически, среди лекарственных средств являются растворы пероксида водорода.
| <== предыдущая страница | | | следующая страница ==> |
| Нитритометрическое титрование | | | Дихроматометрическое титрование |
Дата добавления: 2014-10-10; просмотров: 730; Нарушение авторских прав

Мы поможем в написании ваших работ!